Сегодня чрезвычайно актуальным является вопрос лечения пневмонии, вызванной вирусом SARS-CoV-2. Коронавирусная болезнь (COVID-19) – новая инфекция, против которой нет специфических лекарств и вакцин. Во многом неожиданными оказались ее осложнения. Ведущие специалисты надеются, что в ближайшее время будут разработаны вакцины и/или специальные терапевтические препараты для лечения инфекции SARS-CoV-2. Пока этот поиск продолжается, во всем мире экспериментально применяют различные методы терапии и уже имеющиеся препараты для лечения пациентов с COVID-19.
За период пандемии накоплен большой опыт врачей из многих стран относительно течения коронавирусных пневмоний, их осложнений и причин смерти больных. К сожалению, сейчас нет четких протоколов лечения пневмоний, вызванных новым коронавирусом, поэтому довольно часто врачи дополняют известные схемы лечения вирусно-бактериальных пневмоний препаратами, которые еще не имеют достаточной доказательной базы для терапии именно пневмоний, но которые могут быть полезны благодаря своим уже известным механизмам фармакологического воздействия на определенные звенья патогенеза COVID- 19.
Пандемия новой коронавирусной инфекции, которая развивается вследствие инфицирования вирусом SARS-CoV-2 и тяжелым проявлением которой является острый респираторный дистресс-синдром (ОРДС), обусловила глобальный кризис, представляющий собой крупнейший за последние 100 лет вызов всемирной системе здравоохранения. Примерно у 15–20% пациентов, особенно у лиц пожилого возраста и у тех, кто страдает серьезными сопутствующими заболеваниями, течение болезни является тяжелым, а риск летального исхода составляет 4% [7].
Проникновение SARS-CoV-2 в клетку и развитие иммунного ответа
Основной мишенью вируса являются эпителиоциты легких. Доказано, что SARS-CoV-2 может использовать рецептор ангиотензинпревращающего фермента 2-го типа (АПФ-2) для проникновения в клетки — тот самый рецептор, который облегчает инфицирование эпителия дыхательных путей и альвеолоцитов 2-го типа вирусом SARS-CoV. После связывания вирус SARS-CoV-2 попадает в клетки, затем происходит интернализация, репликация вируса и высвобождение новых вирионов из инфицированной клетки. Они поражают органы-мишени и индуцируют развитие местного и системного воспалительного ответа.
Сейчас окончательно не выяснено, каким образом вирусу удается избежать иммунного ответа и ттимулировать патогенез. Для преодоления противовирусной активности SARS-CoV кодирует вирусные антагонисты, модулирующие индукцию интерферона (ИФН) и цитокинов, — это дает ему возможность уклониться от эффекторной функции сывороточных иммуноглобулинов [8, 9].
В дыхательных путях человека SARS-CoV-2 вызывает подавление активности мукоцилиарного клиренса и гибель эпителиоцитов, проникает сквозь слизистую оболочку носа, гортани и бронхиального дерева в периферическую кровь и поражает органы-мишени — легкие, пищеварительный тракт, сердце, почки. Различают две фазы развития инфекции SARS-CoV-2: раннюю и позднюю.
Ранняя фаза обычно проявляется легкой степенью тяжести заболевания, основную роль в ней играют неспецифические механизмы защиты и специфический адаптивный иммунный ответ, которые позволяют элиминировать вирус из организма. На этом этапе рекомендуется проводить медикаментозные мероприятия, направленные на усиление иммунного ответа [10].
Как и многие вирусы, SARS-CoV-2 кодирует белки, которые противодействуют врожденной иммунной защите, в частности подавляют активность продукции ИФН 1-го типа [11].
Реакция врожденной иммунной системы у инфицированных больных в настоящее время изучена недостаточно. Ключевым проявлением активации врожденного иммунитета при COVID-19 является увеличение количества нейтрофилов, а также повышение концентрации интерлейкина-6 (ИЛ-6) и C-реактивного белка (СРБ) в сыворотке крови [12]. При тяжелых формах COVID-19 развивается лимфоцитопения [13].
Поврежденные клетки, экспрессирующие АПФ-2, продуцируют провоспалительные цитокины, которые рекрутируют эффекторные нейтрофилы) и индуцирующие активность инфламмасом.
Функционирование инфламмасом сопровождается высвобождением значительного провоспалительных цитокинов, которые, в свою очередь, усиливают рекрутинг макрофагов и нейтрофилов, и развитием так называемого цитокинового шторма, что обусловливает чрезвычайный уровень воспалительного процесса в легких.
«Цитокиновый шторм»
«Цитокиновый шторм» характеризуется всплеском выработки провоспалительных цитокинов: ИФН-α и γ, ИЛ-1β, -6, -12, -18, -33, фактора некроза опухоли, гранулоцитарно-макрофагального колониестимулирующего фактора (GM-CSF), хемокинов (CCL2, CCL3, CCL5, CXCL8, CXCL9, CXCL10 и др.). Они рекрутируют эффекторные иммуноциты, что приводит к развитию местного воспалительного ответа. «Цитокиновый шторм» влечет за собой возникновение ОРДС, который сопровождается оксидативным повреждением липидов цитомембран, увеличением содержания активных форм кислорода (АФК) в 10 раз, выбросом лизосомальных протеаз. Развивается апоптоз легочных эпителиальных и эндотелиальных клеток, происходит повреждение клеточного барьера, растет васкулярная проницаемость, следствием чего являются отек и гипоксия. Все это приводит к полиорганной недостаточности, которая может повлечь за собой летальный исход. Установлено, что риск летального исхода заболевания ассоциирован именно с высоким уровнем ИЛ-6 в сыворотке крови [4,14].
Последствиями масштабной вирусной репликации и «цитокинового шторма» является массированное поражение таргетных тканей организма [10]:
- эндотелия сосудов, что вызывает системное воспаление, нарушение коагуляционного гомеостаза, тромбоэмболии;
- легких, что ассоциируется с развитием пневмонии и ОРДС;
- сердечно-сосудистой системы, что приводит к развитию инфарктов, миокардитов и смерти;
- кишечника, что сопровождается диареей;
- почек, что ассоциируется с развитием острой почечной недостаточности;
- других органов и систем.
Высвобождение значительного количества цитокинов тесно связано с развитием известных клинических симптомов COVID-19 [15]:
- ИФН-γ обусловливает лихорадку, озноб, головную боль, головокружение и усталость (синдром эндогенной интоксикации);
- ФНО может быть причиной гриппоподобных симптомов (лихорадки, общего недомогания, слабости) и вызывать повышенную проницаемость сосудов, кардиомиопатию, повреждение легких и синтез белков острой фазы;
- ИЛ-6 способен привести к повышению сосудистой проницаемости, активации системы комплемента и коагуляционного каскада, что ассоциируется характерными симптомами тяжелого синдрома высвобождения цитокинов (СВЦ), в том числе ДВС (ДВС- синдром); кроме того, ИЛ-6, вероятно, обусловливает кардиомиопатию, вызывая дисфункцию миокарда, частонаблюдается у пациентов с СВЦ;
- активация эндотелиальных клеток также может быть одним из признаков тяжелого СВЦ, а эндотелиальная дисфункция может привести капиллярной утечке, гипотензии и коагулопатии.
Эндотелиальная дисфункция
У пациентов с высоким риском развития сердечно-сосудистых заболеваний снижение рецепторов АПФ-2 в сосудистой стенке в результате интернализации рецепторов, вызванной SARS-CoV-2, приводит к обострению сердечно-сосудистых заболеваний, развитию эндотелиальной дисфункции и воспалению, особенно при наличии атеросклероза и диабета [16].
Эндотелиальная дисфункция, в свою очередь, обусловливает развитие воспалительных процессов и тромбообразования, сопровождаемых коагуляции, повышением уровня снижением процессов фибринолиза и антикоагуляции. Значительно уменьшается продукция оксида азота (NO) в результате усиленного его разрушения из-за действия свободных радикалов, снижения предшественника NO — L-аргинина, что приводит к преобладанию действия вазоконстрикторов и усилению адгезии тромбоцитов. Поэтому экзогенное поступление L-аргинина как субстрата для синтеза NO является патогенетически обоснованным путем нивелирования эндотелиальной дисфункции [17].
Поражение респираторной системы
Поражение легких является основной причиной как тяжести течения, так и летальности в связи с COVID-19 [18].
На первом этапе развития поражения легких альвеолярные макрофаги, распознав начинают продуцировать провоспалительные интерлейкины и хемокины, которые рекрутируют эффекторные Т-лимфоциты. В поздний период развития болезни чрезвычайно высокий уровень продукции провоспалительных цитокинов (ИЛ-6, -1β, ФНО и др.) этими клетками обеспечивает приток большого количества моноцитов и нейтрофилов, усиливающих явления воспаления и вызывающих развитие отека ткани легких [10].
ИЛ-1β и ФНО индуцируют активность фермента гиалуронансинтазы-2 в эндотелиальных CD31+- клетках, альвеолярных эпителиальных EpCAM+- клетках легких и в фибробластах, что приводит к избытку продукции гиалуроновой кислоты и накоплению жидкости в альвеолярном пространстве, а это играет ключевую роль в развитии воспаления и отека [19, 20].
Факторы риска, связанные с развитием ОРДС и его прогрессированием вплоть до летального исхода, включают пожилой возраст, повышенное количество нейтрофилов, дисфункцию органов и коагулопатию (например, более высокий уровень лактатдегидрогеназы и содержание D-димера).
Тяжесть повреждения легких коррелирует со значительной легочной инфильтрацией нейтрофилами и макрофагами и более высоким количеством этих клеток в периферической крови. Нейтрофилы являются основным источником хемокинов и цитокинов. Они рекрутируются в легкие цитокинами, которые затем активируются и высвобождают токсичные медиаторы, что сопровождается образованием свободных радикалов и АФК. Последние подавляют антиоксиданты, что приводит к окислительному повреждению клеток легочной ткани [21].
У пациентов с пневмонией, коронавирусной инфекцией, у которых развился ОРДС, наблюдается более высокое, чем у пациентов без ОРДС, количество нейтрофилов. Возможно, это обусловлено активацией нейтрофилов для выполнения реализации иммунного ответа против вируса, но вместе с тем приводит к так называемому цитокиновому шторму [8].
Допускают, что вирус начинает вторую атаку, вызывая ухудшение состояния пациента, примерно через 7–14 дней после начала заболевания. От появления первых симптомов COVID-19 до развития ОРДС в среднем проходит 8 суток [22].
Развитие инфекции, ассоциированной с вирусом SARS-CoV-2, сопровождается избыточной активацией клеточного иммунитета. Также у больных COVID-19 наблюдается высокое содержание провоспалительных CCR6+ Th17-клеток.
Возможно, чрезмерная активация Th17-клеток и чрезвычайно высокий уровень цитотоксичности CD8+ Т- клеток лежат в основе тяжести иммунного повреждения легочной ткани. Кроме того, у больных наблюдается истощение пула Тreg-клеток, что обусловливает неограниченную активацию механизмов воспаления и отдаляет разрешение воспалительного процесса [18].
Поражение сердечно-сосудистой системы
Инфицирование вирусом SARS-CoV-2 может подавлять активность экспрессии АПФ-2, что приводит к токсическому чрезмерному накоплению ангиотензина II, которое вызывает ОРДС и миокардит [23].
Повреждение миокарда, ассоциированное с инфицированием вирусом SARS-CoV-2, которое сопровождалось резким повышением концентрации тропонина I (>28 пг/мл), наблюдалось у 5 из первых 41 пациента с диагнозом COVID-19 в г. Ухань, Китай [24].
У более чем 60% больных, умерших от COVID-19, в анамнезе отмечались артериальная гипертензия, сердечно-сосудистые заболевания или диабет [25].
Существует предположение, что блокада ренин- ангиотензиновой системы увеличивает экспрессию АПФ- 2, обусловливая интернализацию SARS-CoV-2 в клетки легких и сердца, что приводит к ОРДС, миокардиту и смерти [26].
Другие возможные механизмы повреждения миокарда включают «цитокиновый шторм», вызванный дисбалансом ответа Тh1- и Тreg-клеток, и гипоксемию, вызванную COVID-19 [27].
Гиперкоагуляция и тромбоз
Кроме респираторных симптомов (пневмония и ОРДС), у большинства критических больных отмечаются тяжелые системные проявления заболевания и полиорганной недостаточности. Именно поэтому многие пациенты с COVID-19 не реагируют адекватно на респираторную поддержку. Одно из самых значимых проявлений, связанных с плохим прогнозом, — развитие коагулопатии и эндотелиальной дисфункции с диффузным микро- и макротромбозом. При этом больше всего поражаются легкие — из-за высокого уровня воспаления.
Именно этим обосновывается мнение о том, что не стоит рано переводить больных на искусственную вентиляцию легких (ИВЛ), поскольку без адекватного кровотока у них это бесполезно. Основная идея вентиляции — в улучшении оксигенации, для чего необходимо оптимальное соотношение вентиляции и перфузии, а также сохранение механизма венозной гипоксической вазоконстрикции. В действительности 9 из 10 больных умирают от сердечно сосудистых, а не респираторных причин, поскольку именно венозный микротромбоз, а не пневмония, определяет летальность, а у значительной части больных пусковым механизмом дыхательной недостаточности являются тромбоз и эндотелиальная дисфункция [8].
Ряд сообщений указывает на высокую частоту как артериальных, так и венозных тромбоэмболических осложнений у пациентов с COVID-19, что свидетельствует о необходимости использования простых и доступных лабораторных маркеров.
Частота венозной тромбоэмболии может достигать 25%, иногда приводя к смерти. У больных наблюдается повышенная частота возникновения инфарктов, инсультов и других тромботических заболеваний.
Среди гематологических изменений отмечают повышение содержания D-димера, фибриногена и других воспалительных маркеров. В отличие от классического ДВС-синдрома, у этих больных степень увеличения активированного частичного тромбопластиновоговремени зачастую является меньшей, чем удлинение протромбинового времени (вероятно, в связи с повышенным уровнем фактора VIII). ДВС-синдром может развиваться на дальнейших стадиях болезни, вызывая ухудшение прогноза. Учитывая критическую роль тромбовоспаления и эндотелиальной дисфункции в условиях «цитокинового шторма», на ранних этапах болезни следует применять противовоспалительные препараты [28].
Подходы к лечению пациентов с COVID-19 и его осложнениями
Поскольку не существует общепризнанного одобренного метода лечения новой коронавирусной инфекции, специалисты вынуждены использовать препараты, не зарегистрированные как лекарственные средства для терапии именно COVID-19, чтобы облегчить симптомы пациентов. То есть сложилась ситуация, когда более весомое значение, чем принципы доказательной медицины, приобретает практический клинический опыт [29].
Поскольку в настоящее время нет этиотропной терапии с доказанной эффективностью, подходы к лечению пациентов с COVID-19 должны включать патогенетическую, симптоматическую и заместительную терапию.
В руководстве Всемирной Организации здравоохранения от 13 марта 2020 г. указано, что лечение легкой формы COVID-19 должно включать симптоматическую терапию и мониторинг; при тяжелой форме необходимы кислородная терапия, мониторинг и лечение коинфекции. Пациенты в критическом состоянии нуждаются в дополнительных мерах для лечения ОРДС и септического шока и в профилактике осложнений.
У около 15% взрослых, инфицированных SARS-CoV-2, развивается тяжелая пневмония, что требует дополнительной инсуфляции кислорода. У 5% больных течение пневмонии прогрессирует до критического уровня с развитием гипоксемической дыхательной недостаточности, ОРДС и полиорганной недостаточности, требующих респираторной поддержки, зачастую в течение нескольких недель [30].
Пневмония, обусловленная COVID-19, характеризуется увеличением содержания эффекторных Т-клеток, воспалительных цитокинов и D-димера,активацией коагуляционного каскада, повышением уровня фиброза и микроэмболией, что необходимо учитывать при выборе терапевтической стратегии.
Поскольку системное и легочное воспаление, угрожающее жизни, развивается быстро, важным является раннее выявление клинических и гуморальных маркеров, реактивного гипериммунного ответа. Поэтому своевременное начало лечения может кардинально повлиять на эффективность терапии и минимизировать возможное воздействие вирусной репликации [31, 32].
Синдромно-патогенетический подход
Выбирая схему лечения пациентов с COVID-19, следует помнить о минимизации последствий с целью уменьшения частоты инвалидизации и снижения качества жизни тех, кто перенес это тяжелое заболевание. Среди возможных последствий выделяют следующие:
- • прежде всего соматические нарушения: микротромбоэндотелиит — системное поражение сосудов с образованием микротромбов, в результате чего страдают дыхательная, выделительная, сердечно- сосудистая, эндокринная, гастроэнтерологическая системы и т. д.; фиброзные изменения легочной ткани, пневмосклероз. Восстановить проходимость легких помогают медикаментозные методики (бронхо- и муколитики, стероиды), интрапульмональная перкуссионная вентиляция. У пациентов с сахарным диабетом, сосуды которых, особенно мелкие, уже поражены, необходимо корректировать терапию сахароснижающими препаратами;
- последствия лечения опасными препаратами: гастроэнтерологические осложнения вследствие COVID- 19 — это преимущественно печеночная недостаточность, в значительной степени связанная с лекарственным воздействием;
- обострение хронических болезней, изменение характера их течения, что требует коррекции;
- психологические проблемы, развитие депрессии.
При формировании комплекса реабилитационных мероприятий следует учитывать конкретную ситуацию. Чрезвычайную актуальность приобретает применение синдромно-патогенетического подхода, который заключается в лечении не диагноза, а его конкретных проявлений, синдромов. Например, при поражении эндотелия в легких происходит перемещение плазмы в межтканевое пространство, в дальнейшем образуются гиалиновые мембраны, происходит процесс фиброзирования. Впрочем, даже если фиброзные изменения сохраняются длительное время, необходимо руководствоваться синдромным подходом: обеспечивать кислородную поддержку и неинвазивную вентиляцию легких лишь при дыхательной недостаточности. Тем более что применение аппаратов ИВЛ в случае COVID-19 ассоциировано с высокой (до 90%) смертностью, вентилятор-ассоциированными пневмониями и другими осложнениями [33].
Методы фармакотерапии COVID-19
Среди лекарственных средств, используемых дляборьбы с COVID-19, — противовирусные препараты (как в монотерапии, так и в различных комбинациях, включая интерфероны). Например, разработанный комбинированного лечения пациентов нелфинавир включен в список эффективных препаратов для терапии COVID-19 [34].
Есть также данные об эффективности препарата ремдесивир, который воздействует непосредственно на возбудитель коронавирусной инфекции: его применение способствовало улучшению состояния 68% пациентов, сокращая продолжительность пребывания в стационаре с 15 до 11 дней [35].
Фавипиравир, который ранее применяли для лечения гриппа, а сейчас успешно экспериментальное средство терапии воздействует на одно из звеньев репликации вируснойРНК, способствуя снижению частоты летальных исходов вдвое, а серьезных осложнений — в 4 раза [36, 37].
Данные о применении у пациентов с COVID-19 препаратов на основе хлорохина (иногда в сочетании с антибиотиком азитромицином) противовирусное действие эти средства оказывают в высоких концентрациях, что приводит к проявлениям токсичности; кроме того, серьезным нежелательным эффектом их применения является сердечная аритмия [38].
Значительный интерес вызывает препаратов екомбинантных моноклональных антител к рецепторам ИЛ-6 — левилимаба и тоцилизумаба, а также других средств, вызывающих иммуносупрессию, чрезмерно активный иммунный ответ, который может привести к ухудшению клинического состояния. Так, тоцилизумаб блокирует рецепторы способствует позитивному терапевтическому эффекту при многих воспалительных заболеваниях, включая COVID-19 [39].
Ретроспективное исследование применения тоцилизумаба при лечении пациентов сCOVID-19 в тяжелом или критическом состоянии показало, что препарат способствовал улучшению оксигенации у 75% больных и нормализации количества периферических лимфоцитов у 52,6% [40].
Пациенты с ослабленным иммунитетом могут быть более склонными к осложнениям COVID-19 из-за отсутствия быстрого иммунологического помогающего преодолеть вирус. Однако пока есть предположение, что иммуносупрессия способна играть и защитную роль в случае инфицирования COVID-19, предотвращая чрезмерно активный иммунный ответ, который иногда приводит к ухудшению клинического состояния, либо ослабляя его [41].
В частности, описан случай истощения В-клеток, при котором развился COVID-19 без серьезных осложнений у пациента,страдавшего рассеянным бронхиальной астмой и язвенной болезнью. Авторы публикации предполагают, что персистенция В-клеток во вторичных лимфоидных органах, связанная с умеренно пониженным иммунным ответом из-за отсутствия периферических В-клеток, могла сыграть благоприятную роль. То, что у пациента не наблюдалось значительного увеличения содержания ИЛ-6 высвобождаться периферическими вероятно, свидетельствует в пользу этой гипотезы. В случае ее подтверждения большим количеством случаев можно будет предположить, испытывающие истощение В-клеток, приобретают защиту от серьезных осложнений COVID-19. Это будет свидетельствовать в пользу применения селективных иммунодепрессантов при серьезных случаях COVID-19 [42].
Поскольку активность в тканях легких фермента гиалуронансинтазы-2 приводит к избытку продукции гиалуроновой кислоты, существует подавление ее продукции будет способствовать увеличению поверхности газообмена в альвеолах и выздоровлению больных COVID-19. В частности, с этой целью предлагается применять одобренный для лечения дисфункции желчного пузыря препарат гимекромон, который является ингибитором гиалуронансинтазы-2 [13].
Согласно последним клиническим сообщениям, период терапевтического диапазона при COVID-19значительно длиннее 14 дней, но длительное воздействие вируса может приводить к внезапным интенсивным иммунологическим «цитокиновому шторму» и инфильтрации иммунными клетками. Некоторые иммуноциты, особенно макрофаги нейтрофилы, способны продуцировать многочисленные АФК [43, 44].
Определенный уровень АФК важен регулирования иммунологических реакций и для очищения от вирусов, но их чрезмерное содержание приводит к окислению клеточных белков и мембранных липидов, а также к быстрому разрушению не только зараженных вирусом, но и нормальных клеток легких и даже сердца, в результате чего полиорганная недостаточность.
Поэтому антиоксидантная терапия может бытьпредложена как потенциальный терапевтический подход для уменьшения поражения тканей легких и сердечно- сосудистой системы, вызванных COVID-19. Среди потенциальных препаратов называют антиоксиданты, как витамин С (аскорбиновая кислота) и витамин Е, поскольку их возобновляемые атомы водорода могут вступать в реакцию с АФК и нейтрализовать их без образования токсичных веществ. Упоминают также олекулы растительного происхождения (используемые в древнекитайской медицине), такие как куркумин и байкалин [45].
Предполагается, что надлежащая антиоксидантов может способствовать уменьшению повреждений сердца и легких у пациентов с тяжелыми формами COVID-19, но ученые не исключают, что такой подход может быть полезен и для пациентов с легкими симптомами заболевания [46].
Возможности применения эдаравона, L-аргинина, L- карнитина и Реосорбилакта в комплексной терапии пациентов с COVID-19 Потенциальная польза антиоксидантной терапии зависит от правильного выбора лекарственных препаратов. Ключевыми требованиями к ним является способность влиять на митохондриальную проницаемость, блокировать сигнальные пути начала воспаления (ИЛ-1, -6, -18), действовать в синергии с водорастворимыми антиоксидантами (в цитоплазме).
Эдаравон
Эдаравон — низкомолекулярное антиоксидантное средство, целенаправленно взаимодействующее с пероксильными радикалами. Благодаря амфифильности он поглощает как жиро-, так и водорастворимые пероксильные радикалы, передавая радикалу электрон; подавляет окисление липидов путем поглощения водорастворимых пероксильных радикалов, инициирующих цепные химические реакции, а также жирорастворимы пероксильных поддерживающих эту цепочку [47].
В 2001 г. данный препарат был одобрен в Японии как лекарственное средство для терапии ишемического инсульта, а в 2015 г. — для лечения бокового амиотрофического склероза. В рекомендациях японских обществ относительно респираторной поддержки и интенсивной терапии эдаравон указан как препарат, который целесообразно применять для лечения пациентов с ОРДС в отделениях интенсивного лечения [52].
Эдаравон способен быстро нейтрализовать широкий спектр свободных радикалов. Он активирует eNOS и может улучшить кровообращение, воспалительную iNOS; эффективно тормозит перекисное окисление липидов (ПОЛ), защищая клетки от разрушения благодаря подавлению цепной реакции ПОЛ путем поглощения пероксильных радикалов. Эдаравон активирует ферменты антиоксидантной защиты SOD (супероксиддисмутазу), CAT (каталазу), (глутатионпероксидазу).
Препарат легко проникает гематоэнцефалический барьер, в отличие от других акцепторов свободных радикалов, что объясняет его выраженный лечебный эффект; защищает эндотелий головного мозга от повреждения за счет защитного эффекта для микрососудов, что обусловливает его возможное терапевтическое воздействие расстройствах и заболеваниях, карбонильным стрессом [48]. Эдаравон уменьшает повреждения гематоэнцефалического тормозит развитие отека мозга, прямо и косвенно уменьшает выработку провоспалительных цитокинов: ИЛ-6, iNOS, ФНО, металлопротеиназ.
Эдаравон на протяжении уже применяется для лечения пациентов с инсультом (в течение первых 24 часов), но благодаря своим свойствам скавенджера свободных радикалов оказывает защитное действие на сердце, легкие, кишечник, печень, поджелудочную железу, почки и другие органы. Недавнобыло продемонстрировано, что эдаравон полезен для пациентов с острым инфарктом миокарда. Препарат также способствовал увеличению фракции выброса левого желудочка и снижению частоты повторных госпитализаций пациентов с острым инфарктом миокарда. В исследованиях на животных моделях было показано, что эдаравон снижал количество ИЛ-1β-положительных клеток миокарда экспериментальным аутоиммунным защищал сердечную функцию и уменьшал размер инфаркта путем уменьшения продукции ФНО в миокарде [49].
В экспериментальных исследованиях было показано, что эдаравон способен предотвращать развитие повышенной проницаемости микроциркуляторного русла легких, провоспалительными цитокинами, вероятно, благодаря усилению адгезивных контактов, а также других механизмов. Поэтому препарат может быть полезен для лечения пациентов с ОРДС и пневмонией в условиях клинической практики. Безопасность эдаравона доказана в ряде исследований [50, 51].
Таким образом, применение эдаравона — препарата, способного эффективно «гасить цитокиновый пожар», — может способствовать значительному состояния пациентов с COVID-19, патогенез которого связан с развитием ОРДС и резким увеличением содержания цитокинов.
L-аргинин
L-аргинин представляет собой условно незаменимую аминокислоту, которая выступает активным клеточным регулятором многочисленных жизненно важных функций организма, проявляя протекторные эффекты, важные при критическом состоянии. Аргинин антигипоксическое, мембраностабилизирующее, цитопротекторное, антиоксидантное, антирадикальное, дезинтоксикационное действие.
Эта аминокислота является субстратом для синтеза NO и благодаря этому улучшает микроциркуляцию, способствует крепкой вазодилатации, предотвращает активацию и адгезию лимфоцитов и тромбоцитов.
Физиологическое действие NO варьирует от модуляции сосудистой системы до регуляции иммунных процессов (клеточно-опосредованный воздействие ейтрофилов микроорганизмы, неспецифическая иммунная защита) и контроля нейрональных функций. L-аргинин восстанавливает содержание NO в легочной ткани, что уменьшает спазм гладкой мускулатуры бронхов и улучшает вазомоторную функцию эндотелия легочных артерий [53]. L-аргинин эффективно способствует снижению артериального давления у пациентов с артериальной гипертензией [54].
В условиях, когда вакцина против COVID-19 только разрабатывается, а универсального эффективного лечения не существует, возникает вопрос: каким образом можно обеспечить избежание поражения? Особенноактуален он для лиц пожилого возраста и медицински скомпрометированных пациентов. По мнению специалистов, перспективным является применение препаратов, способствующих общему укреплению организма и улучшающих защитную способность иммунитета. К таким веществам, безусловно, относится L-аргинин.
Целесообразность такого подхода подтверждает начатое в Медицинском центре университета штата Огайо, США, клиническое испытание с использованием ингаляционного NO для лечения пациентов, у которых диагностирован COVID-19. Цель — избежать интенсивной терапии [56].
Таким образом, увеличение содержания NO является перспективным направлением лечения пациентов с коронавирусной инфекцией, а L-аргинин может успешно применяться для достижения этой цели.
L-карнитин
L-карнитин является природным веществом, принимающим участие в энергетическом метаболизме, а также метаболизме кетоновых тел. Он необходим для транспортировки в митохондрии длинноцепочечных жирных кислот (используемых в качестве энергетического субстрата всеми тканями, за исключением мозга) для их дальнейшего β-окисления и образования энергии.
Это вещество играет важную роль в сердечном метаболизме, поскольку окисление жирных кислотз ависит от наличия его в достаточном количестве. Доказано положительное действие L-карнитина при острой и хронической ишемии, декомпенсации сердечной деятельности, сердечной недостаточности, вызванной миокардитом, медикаментозной кардиотоксичности.
Иммуномодулирующий эффект L-карнитина заключается в подавлении провоспалительных цитокинов ФНО, ИЛ-6 и ИЛ1 в условиях «цитокинового шторма». Препарат является прямым антиоксидантом, предотвращает апоптоз клеток, оказывает кардиопротекторный эффект.
Результаты двух масштабных метаанализов — DiNicolantonio (2013) и Askarpour и соавт. (2019) — подтверждают эффективность терапии L-карнитином у пациентов с сердечно-сосудистыми заболеваниями благодаря уменьшению смертности, улучшению качества жизни, снижению уровня холестерина, нормализации сердечного ритма, уменьшению потребности в нитратах [57, 58].
L-карнитин может быть полезен для пациентов с COVID-19 благодаря его иммуномодулирующему воздействию и подавлению угнетению медиаторов воспаления, в частности СРБ, ФНО и ИЛ-6, что можетспособствовать уменьшению «цитокинового шторма» [59].
Реосорбилакт
Реосорбилакт — уникальный гиперосмолярный кристаллоидный раствор, который не содержит избытка хлора, а следовательно, лишен основного недостатка таких растворов — повышения риска развития гиперхлоремии.
Важным отличием препарата Реосорбилакт является сочетание как гиперосмолярных свойств, так и свойств сбалансированных кристаллоидов (набор необходимых ионов Са2+, К+, Na+, Mg2+ в изоплазматической концентрации).
Благодаря гиперосмолярности Реосорбилакт вызывает переход жидкости из межклеточного сектора в сосудистое русло, что улучшает микроциркуляцию перфузию тканей благодаря мощному осмодиуретическому эффекту сорбитола, связанному с отсутствием у человека природных механизмов реабсорбции многоатомных спиртов в проксимальных почечных канальцах. Реосорбилакт обладает выраженным диуретическими противоотечным действием [60].
Основными фармакологически активными веществами препарата являются сорбитол и натрия лактат. Сорбитол улучшает микроциркуляцию и перфузию тканей, оказывает дезагрегантное действие.
Натрия лактат способствует коррекцииметаболического ацидоза; натрия хлорид оказывает регидратальное действие, восполняет дефицит ионов натрия и хлора при различных патологических состояниях; кальция хлорид восстанавливает содержание ионов кальция, необходимых для осуществления передачи нервных импульсов, сокращения скелетных и неисчерченных мышц, деятельности миокарда, формирования костной ткани, свертывания крови, предотвращает развитие воспалительных реакций, повышает устойчивость организма к инфекциям; калия хлорид восстанавливает водно-электролитный баланс, оказывает отрицательное хроно- и батмотропное действие, умеренное диуретическое действие.
В ряде исследований обнаружено, что применение гипертонического раствора у пациентов геморрагическим шоком вследствие травмы снижает продолжительность пребывания на ИВЛ. Установлено также, что применение гиперосмолярных растворов в терапии больных тяжелым сепсисом позволяет уменьшить объем инфузии.Такие положительные эффекты, как уменьшение частоты легочных осложнений,длительности пребывания на ИВЛ, объема инфузии, важны и перспективны при применении гиперосмолярных растворов у больных пневмонией, в частности вызванной COVID-19, когда важно соблюдать рестриктивный режим инфузии [61, 62] .
Цель испытания
С учетом вышеизложенного нами было проведено исследование эффективности синдромно- патогенетического подхода. Цель — оценить влияние комбинации препаратов эдаравон (Ксаврон), L-аргинина гидрохлорид + L-карнитин (Тиворель) и Реосорбилакт (сорбитол, натрия лактат, натрия хлорид, кальция хлорид, калия хлорид, магния хлорид) на течение пневмоний средней тяжести, вызванных COVID-19, в дополнение к базисной терапии в условиях пульмонологического отделения.
Дизайн испытания
В исследование вошли две группы по 30 пациентов каждая с диагнозом пневмонии средней степени тяжести, вызванной COVID-19. Основная группа в дополнение к базисной терапии получала комбинацию препаратов эдаравон (Ксаврон) 30 мг 2 р/сутки внутривенно, L-аргинина гидрохлорид + L-карнитин (Тиворель) 1 флакон/сутки внутривенно и Реосорбилакт 200 мл/сутки. Группа контроля получала базисную терапию.
Контрольные точки
Исследуемыми показателями были: количество койко-дней, проведенных в стационаре, сатурация (насыщение крови кислородом), температура тела, уровень ферритина, D-димера, СРБ, прокальцитонина; общий клинический анализ крови с определением количества эритроцитов, лейкоцитов, тромбоцитов, СОЭ, лейкоцитарной формулы, содержания гемоглобина.
Также пациентам выполнялась компьютерная томография органов грудной клетки.
Биохимический анализ крови не дает специфической информации, но выявленные отклонения могут указывать на наличие органной дисфункции, декомпенсацию сопутствующих заболеваний и развитие осложнений; имеют прогностическое значение, указывают на эффективность выбора лекарственных средств.
Содержание ферритина.Гиперферитинемиюназывают маркером тяжелого течения коронавирусной инфекции, ассоциированным с высоким риском развития «цитокинового шторма». Отмечается, что исследователи во всем мире ищут способ быстро снижать уровень ферритина в крови таких пациентов.
Содержание D-димера, которое в 3–4 раза выше по сравнению с возрастной нормой, имеет клиническое значение.
Содержание СРБ является основным лабораторным маркером активности процесса в легких; его повышение коррелирует с объемом поражения легочной ткани и служит основанием для начала противовоспалительной терапии.
Лимфо- и тромбоцитопения. У большинства пациентов с COVID-19 количество лейкоцитов является нормальным; у одной трети обнаруживается лейкопения, а у 83,2% — лимфопения; тромбоцитопения имеет умеренный характер, но чаще встречается у пациентов с тяжелым течением заболевания.
Лабораторными признаками «цитокинового шторма» и ОРДС могут быть: внезапное нарастание клинических проявлений через 1–2 нед. с начала заболевания; фебрильная лихорадка, нарастающая или появившаяся снова; выраженная лимфопения в общем анализе крови; уменьшение количестваТ-и В-лимфоцитов; значительное повышение уровня D-димера (>1500) или его быстрое нарастание; повышение содержания СРБ >75 мг/л.
Развитие сердечно-сосудистых осложнений при COVID-19 также сопровождается лимфо- тромбоцитопенией, повышением уровня СРБ.
Результаты и обсуждение
На рисунке 1 показаны средние значения содержания СРБ (мг/л) до и после лечения у пациентов основной и контрольной групп. Если до лечения разница между показателями была статистически недостоверной (39,45 ± 9,7 против 46,26 ± 5,53 мг/мл соответственно), то после лечения у пациентов основной группы показатель значимо улучшился по сравнению с контрольной группой (7,59 ± 1,71 против 12,5 ± 1,67 мг/мл соответственно; p = 0,04).
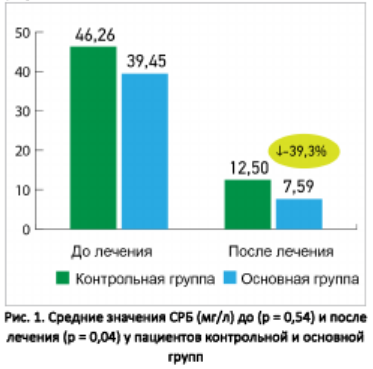
На рисунке 2 показаны средние значения содержания D-димера (нг/мл) до и после лечения у пациентов основной и контрольной групп. До начала лечения разница между показателями была статистически недостоверной (1304,54 ± 230,32 против 1541,06 ± 477,79 нг/мл соответственно), после лечения у пациентов основной группы показатель значимо улучшился по сравнению с контрольной группой (1445,38 ± 106 , 03 против 1903,27 ± 129,68 нг/мл; p = 0,01).
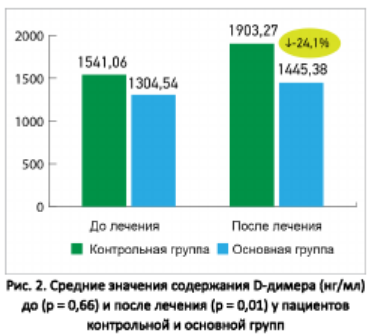
На рисунке 3 показаны средние значения содержания ферритина (нг/мл) до и после лечения у пациентов основной и контрольной групп. До начала лечения разница между показателями была статистически недостоверной (500,6 ± 89,14 против 598 ± 94,03 нг/мл соответственно), после лечения у пациентов основной группы показатель значимо улучшился по сравнению с контрольной группой (393,72 ± 51,73 против 540,11 ± 49,93 нг/мл соответственно; p = 0,05).
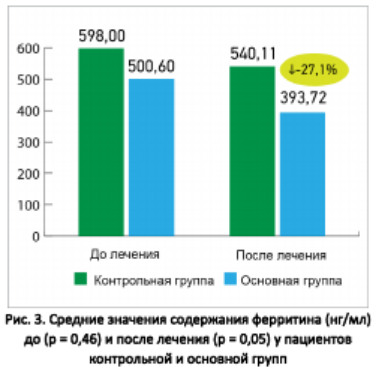
Рисунок 4 дает возможность сравнить средние значения продолжительности лечения, температуры тела и сатурации у пациентов основной и контрольной групп. Все показатели на момент завершения лечения были значимо лучше у пациентов основной группы (сочетание основной терапии с дополнительным лечением препара- тами Ксаврон, Тиворель и Реосорбилакт), чем в контрольной группе: сатурация составила 93,31 ± 0,57 против 91,24 ± 0,77 (% насыщения крови кислородом; p =0,03), температура тела — 37,86 ± 0,1 против 38,18 ± 0,12 (° С; p = 0,04), количество койко-дней в стационаре — 13,1 ± 0,49 против 14,56 ± 0,42 (p = 0,03) соответственно.

Выводы
• Результаты исследования показали, что в основной группе (пациенты которой наряду с основной терапией пневмонии, вызванной COVID-19, получали дополнительную терапию препаратами Ксаврон, Тиворель и Реосорбилакт) достоверно улучшился ряд показателей по сравнению с контрольной группой (только основная терапия). Дополнительное лечение способствовало улучшению насыщенности крови кислородом, снижению температуры тела, а также сокращению пребывания пациентов в стационаре.
• На момент завершения лечения в основной группе достоверно снизилась концентрация СРБ — маркера активности воспалительного процесса в легких, повышение уровня которого коррелирует с объемом поражения легочной ткани и тяжестью течения заболевания.
•Уменьшение содержания D-димера, который тоже относится к маркерам воспалительного процесса, у пациентов основной группы свидетельствует об улучшении их состояния по сравнению с контрольной группой.
•Увеличение концентрации острофазового белка ферритина отмечают в случае неблагоприятного течения заболевания и так называемого цитокинового шторма, то есть снижение указанного показателя в основной группе является доказательством эффективности дополнительной терапии препаратами Ксаврон, Тиворель и Реосорбилакт.
• В настоящее время уделяется особое внимание применению синдромно-патогенетического подхода в лечении коронавирусной инфекции, поскольку этиотропные лекарственные средства, действующие непосредственно на возбудитель COVID-19, еще не разработаны. В этих условиях чрезвычайно важным является использование комплексного подхода в лечении пациентов с тяжелыми формами заболевания, при котором будут учтены индивидуальные особенности и обеспечена максимально эффективная поддержка организма. Следует также делать все возможное для предотвращения инвалидизации и снижения качества жизни пациентов после перенесенной болезни из-за возможных осложнений (поражение дыхательной системы вследствие фиброза, тяжелые последствия для сердечно-сосудистой системы в связи тромбообразованием и т. д.). Этому будет способствовать дополнительное применение препаратов Ксаврон, Тиворель и Реосорбилакт.
Перспективы дальнейших исследований
Установлено, что, кроме пневмоний, COVID-19 сопровождается развитием дыхательной недостаточности, изменениями реологических фибринолитических свойств крови, повышенны тромбообразованием, поражением сердечно-сосудистой и нервной систем, повышенным фиброзообразованием в легких. В ходе исследования была отмечена тенденция к уменьшению проявлений фиброза легких в основной группе. Поэтому целесообразно было бы исследовать воздействие предложенной нами комбинациипрепаратов на процессы фиброзообразования в легких после перенесенных вирусных пневмоний, учитывая широкий спектр уже известных лечебных свойств данных средств.
Автор статьи: С.В. Коваленко, д. м. н., кафедра внутренней медицины, клинической фармакологии и профессиональных болезней Буковинского государственного медицинского университета; пульмонологическое отделение Черновицкой областной клинической больницы.
Опубликовано: Медицинская газета «Здоровье Украины», № 13-14 (482-483), Июль 2020