Методы коррекции неврологических нарушений у пациентов с коронавирусной болезнью (COVID-19)
Цель работы. Проанализировать частоту возникновения и спектр неврологических нарушений у пациентов с коронавирусной болезнью, совершенствование патогенетического лечения. Материалы и методы. Обследовано 83 пациента с коронавирусной болезнью, госпитализированных в КНП ХОР «Областная клиническая инфекционная больница» за период с мая по декабрь 2020 г. Пациенты были поделены на группы в зависимости от степени тяжести болезни и в зависимости от […]
Опубликовано: Клиническая инфектология и паразитология, 2021, том 10, № 2
Эффективность комбинированной терапии препаратами Ксаврон, Тиворель и Реосорбилакт у пациентов с пневмонией, вызванной COVID-19: клинические случаи
В публикации представлена серия клинических случаев пациентов с пневмониями, вызванными COVID-19, в схему лечения которых были включены препараты Ксаврон, Тиворель и Реосорбилакт, что позволило быстро достичь улучшения состояния пациентов и способствовало облегчению течения заболевания В условиях, когда этиотропные препараты, действующие непосредственно на возбудитель COVID-19, еще не разработаны, чрезвычайно важным является комплексный синдромно-патогенетический подход к лечению […]
Опубликовано: Новости медицины и фармации, № 1,2, 2021.
Нейроинвазия при коронавирусной инфекции – патогенез и перспективы лечения
Вирус SARS-CoV-2 имеет тропизм к клеткам центральной нервной системы и может вызывать развитие неврологической симптоматики у инфицированных пациентов. В этом отношении введение в схему интенсивной терапии препарата Ксаврон® (эдаравон) может быть целесообразным исходя из его особенностей уменьшать проявление не только оксидативного стресса, но и явлений «цитокинового шторма» в виде значительного уменьшения интерлейкина-6, тем самым купируя […]
Опубликовано: Спецвыпуск «Инсульт», 2021 р. Здоровье Украины
На передовой борьбы с COVID-19 – опыт украинских специалистов (ВИДЕО)
Врачи всего мира до сих пор ищут и не могут найти эффективные средства борьбы с COVID-19. Поэтому каждый практический опыт является бесценным. Давайте узнаем чем украинские врачи спасают жизни населения. Последним опытом с передовой отечественные специалисты делились в рамках докладов IV Международного Конгресса по Инфузионной Терапии. Предлагаем Вашему вниманию краткий обзор секции, которая вызвала наибольшее […]
Опубликовано: IV Международный конгресс по инфузионной терапии (12-13 октября 2020 года)
Эдаравон: акцептор свободных радикалов с многочисленными плейотропными эффектами может оказаться революционным продуктом относительно предупреждения и облегчения цитокинового шторма, вызванного COVID-19
В процессе такого нормального физиологического процесса, как клеточное дыхание, образуется небольшое количество окислительных активных форм кислорода (АФК) и активных форм азота (АФА). Эти свободные радикалы играют ключевую роль в активации сигнальных путей в клетках животных и растений. Это химически высокоактивные молекулы, которые могут повреждать клеточные структуры. Однако существуют системы защиты (акцепторные) или актиоксидантные системы, защищающие […]
Нейроинвазия и неврологические осложнения при COVID-19 (ВИДЕО)
В видео на основе имеющихся публикаций систематизированы сведения о механизмах нейроинвазии, об основных формах поражения нервной системы, их клинических проявлениях при СOVID-19. Обсуждаются методы диагностики и лечебная тактика при различных нозологических формах. Представлено пилотное исследование изучения влияния эдаравона на манифестацию IL-6 у пациентов с COVID-19.
Опубликовано: IV Международный конгресс по инфузионной терапии (12-13 октября 2020 года)
Потенциальные возможности лечения COVID-19: противодействие чрезмерному воспалению, антиоксидантное влияние и цитопротекция
Ввиду опасности нестихающей пандемии, существует потребность в разработке новых схем лечения коронавирусной болезни (COVID- 19), в том числе, в переосмыслении уже знакомых, хорошо изученных препаратов и применении их в новом контексте. В публикации представлен собственный опыт ведущих отечественных специалистов лечения COVID-19, который прозвучал в рамках докладов IV Международного Конгресса по Инфузионной терапии.
Опубликовано: Медицинская газета «Здоровье Украины», 2020
Эдаравон: потенциальное лечение воспалительного синдрома, вызванного COVID-19?
В публикации представлен механизм действия молекулы: эдаравон снижает уровень определенных цитокинов (IL-2, IL-6, IL-1β, TNF-α) и хемокинов (IL-8, MCP-1, MIP-1a, 2,5), активные формы кислорода и оксида азота. Предложен дизайн исследования, клиническим исходом которого, ученые видят уменьшение повреждения органов, значительное сокращение клинических осложнений и смертности. Авторы: Sandra E. Reznik, Department of Pharmaceutical Sciences, College of Pharmacy […]
Опубликовано: Pharmacological Research 160 (2020) 105055
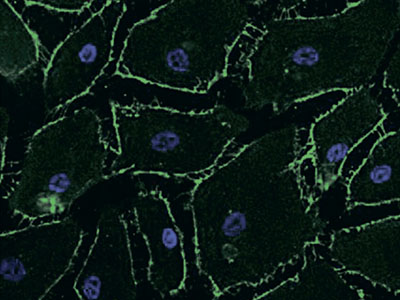
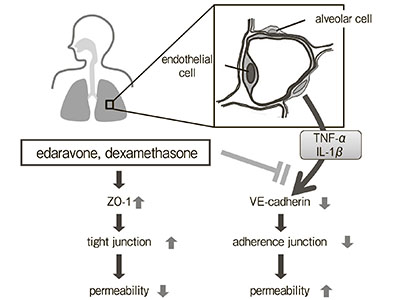
Ингибирующий эффект эдаравона, акцептора свободных радикалов, на повышенную проницаемость эндотелиоцитов микроциркуляторного русла легких, вызванную цитокинами: сравнение с дексаметазоном и ингибитором синтазы оксида азота
Повышенная легочная проницаемость играет роль в развитии острого респираторного дистресс-синдрома (ОРДС), однако на данный момент не существует доказанных терапевтических стратегий по контролю проницаемости микроциркуляторного русла. Мы исследовали эффекты эдаравона, дексаметазона и N-монометил-L-аргинина (L-NMMA) на изменения проницаемости эндотелиоцитов микроциркуляторного русла легких человека (PMVEC — pulmonary microvascular endothelial cells) при гиперцитокинемии. Человеческие PMVEC были засеяны в камеру […]
Опыт применения синдромно-патогенетической терапии при пневмонии, вызванной covid-19 в условиях пульмонологического отделения
Сегодня чрезвычайно актуальным является вопрос лечения пневмонии, вызванной вирусом SARS-CoV-2. Коронавирусная болезнь (COVID-19) – новая инфекция, против которой нет специфических лекарств и вакцин. Во многом неожиданными оказались ее осложнения. Ведущие специалисты надеются, что в ближайшее время будут разработаны вакцины и/или специальные терапевтические препараты для лечения инфекции SARS-CoV-2. Пока этот поиск продолжается, во всем мире экспериментально […]
Опубликовано: Медицинская газета «Здоровье Украины», № 13-14 (482-483), Июль 2020