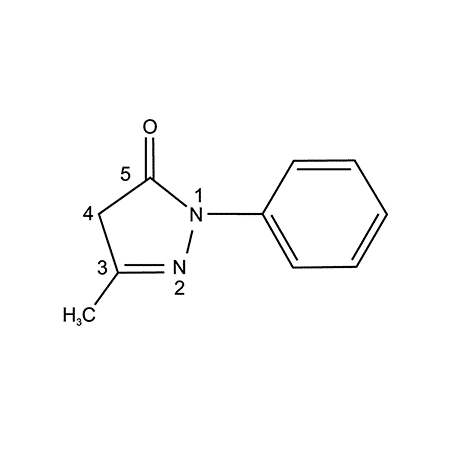
Эффективность длительной терапии антиоксидантом со свойствами скэвенджера у пациентов с боковым амиоторофичним склерозом
Вашему вниманию представлен обзор статьи J. Shefner et al. «Long-term edaravone efficacy in amyotrophic lateral sclerosis: Post-hoc analyses of Study 19 (MCI186-19) », опубликованной в издании Muscle Nerve (2020; 61: 218-242), которая содержит анализ данных об эффективности длительной терапии антиоксидантом эдаравоном для уменьшения прогрессирования этого тяжелого заболевания. Для лучшего понимания долгосрочной эффективности терапии эдаравоном у […]
Опубликовано: НЕЙРОNEWS 1, 2021
СПОСОБНОСТЬ ЭДАРАВОНА снижать повышенный уровень легкой цепи нейрофиламента у пациентов с боковым амиотрофическим склерозом
В исследовании оценивали динамику уровней легкой цепи нейрофиламента в сыворотке крови и функционального состояния пациента по шкале ALSFRS-R у пациентов с боковым амиотрофическим склерозом на фоне приема препарата Ксаврон. Содержание легкой цепи нейрофиламента сыворотки крови коррелирует со степенью хронического или острого повреждения мотонейронов при БАС и является биомаркером активности процесса и прогрессирования заболевания. Вероятная способность […]
Опубликовано: НЕЙРОNEWS, 10 (121) "2020, стр. 38-44.
Важность немоторных симптомов в клинической картине болезни двигательного нейрона
Немоторные симптомы являются облигатным признаком болезни мотонейрона и часто могут быть чувствительным индикатором общего функционального состояния больных. В структуре немоторных симптомов у больных БАС преобладают желудочно-кишечные нарушения, потеря массы тела, боль, потливость и беспокойство. Наличие у пациентов немоторных симптомов свидетельствует о мультисистемном характере этого заболевания. Использование шкалы немотороных симптомов (ШНС) у пациентов с БАС на […]
Опубликовано: Украинский Неврологический журнал 2020, №3
Насколько эффективен эдаравон при лечении острого ишемического инсульта и бокового амиотрофического склероза?
Резюме. Эдаравон является низкомолекулярным антиоксидантным средством, которое среди многих видов активных форм кислорода целенаправленно взаимодействует с пероксильными радикалами. Благодаря своей амфифильности он поглощает как жиро-, так и водорастворимые пероксильные радикалы, передавая радикалу электрон. Таким образом, он ингибирует окисление липидов путем поглощения водорастворимых пероксильных радикалов, инициирующих цепные химические реакции, а также жирорастворимых пероксильных радикалов, поддерживающих данную цепь. […]
Опубликовано: J. Clin. Biochem. Nutr. January 2018. Vol. 62, № 1. Р. 20-38
Законодательство Украины по обеспечению профилактики и лечения редких (орфанных) заболеваний
С 1 января 2015 г. вступили в силу изменения к Закону Украины «Основы законодательства Украины об охране здоровья», введенные Законом Украины от 15.04.2014 № 1213-VII. Согласно введенным в законодательство изменениям, страдающие редкими (орфанными) заболеваниями бесперебойно и бесплатно обеспечиваются необходимыми для лечения этих заболеваний лекарственными средствами и соответствующими пищевыми продуктами для специального диетического потребления в соответствии с их перечнем […]
Опубликовано: Відомості Верховної Ради (ВВР), 2014, № 26; Постанова Кабінету міністрів України №160 від 31.03.2015 р.
Расширенная пересмотрена шкала оценки БАС (ALSFRS-R)
Функциональная шкала оценки БАС (ALSFRS) – это инструмент для мониторинга прогрессирования инвалидности у пациентов с боковым амиотрофическим склерозом (БАС). Недостаток ALSFRS состоит в том, что у нее непропорционально завышен вес оценки бульбарных функций и функциональности конечностей по сравнению с оценкой дисфункции дыхательных путей. Расширенная пересмотренная шкала оценки БАС (ALSFRS-R) сохраняет свойства оригинальной шкалы, при этом демонстрируя валидную […]
Опубликовано: версия – май 2015 г.
Безопасность и эффективность эдаравона у пациентов с боковым амиотрофическим склерозом: рандомизированное, двойное слепое плацебо-контролируемое исследование
В этом рандомизированном двойном слепом параллельном исследовании (Фаза ІІІ) приняли участие пациенты в возрасте 20–75 лет с БАС 1 или 2 степени тяжести из 31 больницы в Японии. У пациентов была оценка не менее 2 баллов по каждому из всех 12 пунктов ALSFRS-R, форсированная емкость легких ≥ 80% и установленный или вероятный БАС в соответствии […]
Опубликовано: сайт thelancet.com/neurology, 15 мая 2017.
В 2017 году FDA утвердило новый препарат для лечения бокового амиотрофического склероза (пресс-релиз на английском языке)
5 мая 2017 года Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) утвердило эдаравон как официально рекомендованный препарат для лечения пациентов с боковым амиотрофическим склерозом (БАС). The U.S. Food and Drug Administration today approved Radicava (edaravone) to treat patients with amyotrophic lateral sclerosis (ALS), commonly referred to as Lou Gehrig’s disease. […]
Опубликовано: офіційний сайт FDA, травень 2017.