На сьогодні надзвичайно актуальним є питання лікування пневмонії, спричиненої вірусом SARS-CoV-2. Коронавірусна хвороба (COVID-19) – нова інфекція, проти якої немає специфічних ліків і вакцин. Багато в чому несподіваними виявилися її ускладнення. Провідні спеціалісти сподіваються, що найближчим часом будуть розроблені вакцини та/або спеціальні терапевтичні препарати для лікування інфекції SARS-CoV-2. Поки цей пошук триває, лікарі в усьому світі експериментально застосовують різні методи терапії та вже наявні препарати для лікування пацієнтів із COVID-19.
За період пандемії накопичено великий досвід лікарів із багатьох країн щодо перебігу коронавірусних пневмоній, їх ускладнень і причин смерті хворих. На жаль, нині немає чітких протоколів лікування пневмоній, спричинених новим коронавірусом, тому досить часто лікарі доповнюють відомі схеми лікування вірусно-бактеріальних пневмоній препаратами, котрі ще не мають достатньої доказової бази щодо терапії саме пневмоній, але котрі можуть бути корисними завдяки своїм уже відомим механізмам фармакологічного впливу на певні ланки патогенезу COVID-19.
Пандемія нової коронавірусної інфекції, що розвивається внаслідок інфікування вірусом SARS-CoV-2 і тяжким проявом якої є гострий респіраторний дистрес-синдром (ГРДС), зумовила глобальну кризу, що являє собою найбільший за останні 100 років виклик всесвітній системі охорони здоров’я. Приблизно в 15-20% пацієнтів, особливо осіб літнього віку та в тих, хто страждає на серйозні супутні захворювання, перебіг хвороби є тяжким, а ризик летального результату становить 4% [7].
Проникнення SARS-CoV-2 у клітину та розвиток імунної відповіді
Основною мішенню вірусу є епітеліоцити легень. Доведено, що SARS-CoV-2 може використовувати рецептор ангіотензинперетворювального ферменту 2 типу (AПФ-2) для проникнення в клітини – той самий рецептор, який полегшує інфікування епітелію дихальних шляхів і альвеолоцитів 2 типу вірусом SARS-CoV. Після зв’язування вірус SARS-CoV-2 потрапляє в клітини, потім відбувається інтерналізація, реплікація вірусу й вивільнення нових віріонів з інфікованої клітини. Вони вражають органи-мішені й індукують розвиток місцевої та системної запальної відповіді.
Нині остаточно не з’ясовано, яким саме чином вірусу вдається уникнути імунної відповіді та стимулювати патогенез. Для подолання противірусної активності SARS-CoV кодує вірусні антагоністи, котрі модулюють індукцію інтерферону (ІФН) і цитокінів – це дає йому змогу ухилитися від ефекторної функції сироваткових імуноглобулінів [8, 9].
У дихальних шляхах людини SARS-CoV-2 зумовлює пригнічення активності мукоциліарного кліренсу й загибель епітеліоцитів, проникає крізь слизову оболонку носа, гортані та бронхіального дерева в периферичну кров і вражає органи-мішені – легені, травний тракт, серце, нирки. Розрізняють дві фази розвитку інфекції SARS-CoV-2 – ранню та пізню.
Рання фаза зазвичай проявляється легким ступенем тяжкості захворювання, основну роль у ній відіграють неспецифічні механізми захисту та специфічна адаптивна імунна відповідь, які дають змогу елімінувати вірус з організму. На цьому етапі рекомендується проводити медикаментозні заходи, спрямовані на посилення імунної відповіді [10].
Як і багато вірусів, SARS-CoV-2 кодує протеїни, що протидіють вродженому імунному захисту, зокрема пригнічують активність продукції ІФН 1 типу [11].
Реакція вродженої імунної системи в інфікованих хворих нині вивчена недостатньо. Ключовим проявом активації вродженого імунітету при COVID-19 є збільшення кількості нейтрофілів, а також підвищення концентрації інтерлейкіну-6 (ІЛ-6) і C-реактивного білка (СРБ) у сироватці крові [12]. За тяжких форм COVID-19 розвивається лімфоцитопенія [13].
Пошкоджені клітини, що експресують AПФ-2, продукують прозапальні цитокіни, котрі рекрутують ефекторні клітини (макрофаги, нейтрофіли) та вивільняють аларміни, що індукують активність інфламасом. Функціонування інфламасом супроводжується вивільненням значної кількості прозапальних цитокінів, які, своєю чергою, підсилюють рекрутинг макрофагів і нейтрофілів, і розвитком так званого цитокінового шторму, що зумовлює надзвичайний рівень запального процесу в легенях.
«Цитокіновий шторм»
«Цитокіновий шторм» характеризується сплеском продукування прозапальних цитокінів: ІФН-α та γ, ІЛ-1β, -6, -12, -18, -33, фактора некрозу пухлини, гранулоцитарно-макрофагального колонієстимулювального фактора (GM-CSF), хемокінів (CCL2, CCL3, CCL5, CXCL8, CXCL9, CXCL10 та ін.). Вони рекрутують ефекторні імуноцити, що призводить до розвитку місцевої запальної відповіді. «Цитокіновий шторм» спричиняє виникнення ГРДС, що супроводжується оксидативним пошкодженням ліпідів цитомембран, збільшенням умісту активних форм кисню (АФК) у 10 разів, викидом лізосомальних протеаз. Розвивається апоптоз легеневих епітеліальних та ендотеліальних клітин, відбувається ушкодження клітинного бар’єра, зростає васкулярна проникність, наслідком чого є набряк і гіпоксія. Усе це призводить до поліорганної недостатності, що може спричинити летальний результат. Установлено, що ризик летального результату захворювання асоційований саме з високим рівнем ІЛ-6 у сироватці крові [4, 14].
Наслідками масштабної вірусної реплікації та «цитокінового шторму» є масоване ураження таргетних тканин організму [10]:
- ендотелію судин, що спричиняє системне запалення, порушення коагуляційного гомеостазу, тромбоемболії;
- легень, що асоціюється з розвитком пневмонії та ГРДС;
- серцево-судинної системи, що призводить до розвитку інфарктів, міокардитів і смерті;
- кишечнику, що супроводжується діареєю;
- нирок, що асоціюється з розвитком гострої ниркової недостатності;
- інших органів і систем.
Вивільнення значної кількості цитокінів тісно пов’язане з розвитком відомих клінічних симптомів COVID-19 [15]:
- ІФН-γ зумовлює лихоманку, озноб, головний біль, запаморочення та втому (синдром ендогенної інтоксикації);
- ФНП може бути причиною грипоподібних симптомів (лихоманки, загального нездужання, слабкості) та зумовлювати підвищену проникність судин, кардіоміопатію, пошкодження легень і синтез білків гострої фази;
- ІЛ-6 здатний призводити до підвищення судинної проникності, активації системи комплементу й коагуляційного каскаду, що асоціюється з характерними симптомами тяжкого синдрому вивільнення цитокінів (СВЦ), зокрема дисемінованим внутрішньосудинним згортанням крові (ДВС-синдром); окрім того, ІЛ-6, імовірно, зумовлює кардіоміопатію, спричиняючи дисфункцію міокарда, що часто спостерігається в пацієнтів із СВЦ;
- активація ендотеліальних клітин також може бути одною з ознак тяжкого СВЦ, а ендотеліальна дисфункція може призвести до капілярного витоку, гіпотензії та коагулопатії.
Ендотеліальна дисфункція
У пацієнтів із високим ризиком розвитку серцево-судинних захворювань зниження експресії рецепторів АПФ-2 у судинній стінці в результаті інтерналізації рецепторів, спричиненої SARS-CoV-2, призводить до загострення серцево-судинних захворювань, розвитку ендотеліальної дисфункції та запалення, особливо за наявності атеросклерозу й діабету [16].
Ендотеліальна дисфункція, своєю чергою, зумовлює розвиток запальних процесів і тромбоутворення, що супроводжується порушенням коагуляції, підвищенням рівня фібриногену, зниженням процесів фібринолізу й антикоагуляції. Значно зменшується продукція оксиду азоту (NO) внаслідок посиленого його руйнування через дію вільних радикалів, зниження доступності попередника NO – L-аргініну, що призводить до переважання дії вазоконстрикторів і посилення адгезії тромбоцитів. Тому екзогенне надходження L-аргініну як субстрату для синтезу NO є патогенетично обґрунтованим шляхом нівелювання ендотеліальної дисфункції [17].
Ураження респіраторної системи
Ураження легень є основною причиною як тяжкості перебігу, так і летальності за COVID-19 [18].
На першому етапі розвитку ураження легень альвеолярні макрофаги, розпізнавши SARS-CoV-2, починають продукувати прозапальні інтерлейкіни й хемокіни, котрі рекрутують ефекторні Т-лімфоцити. У пізньому періоді розвитку хвороби надзвичайно високий рівень продукції прозапальних цитокінів (ІЛ-6, -1β, ФНП та ін.) цими клітинами забезпечує приплив великої кількості моноцитів і нейтрофілів, які посилюють явища запалення та спричиняють розвиток набряку тканини легень [10].
ІЛ-1β та ФНП індукують активність ферменту гіалуронансинтази-2 в ендотеліальних CD31+-клітинах, альвеолярних епітеліальних EpCAM+-клітинах легень й у фібробластах, що призводить до надлишку продукції гіалуронової кислоти та накопичення рідини в альвеолярному просторі, а це відіграє ключову роль у розвитку запалення й набряку [19, 20].
Фактори ризику, пов’язані з розвитком ГРДС і його прогресуванням аж до летального результату, включають похилий вік, підвищену кількість нейтрофілів, дисфункцію органів і коагулопатію (наприклад, вищий рівень активності лактатдегідрогенази та вміст D-димеру).
Тяжкість пошкодження легень корелює зі значною легеневою інфільтрацією нейтрофілами й макрофагами та вищою кількістю цих клітин у периферичній крові. Нейтрофіли є основним джерелом хемокінів і цитокінів. Вони рекрутуються в легені цитокінами, котрі потім активуються й вивільняють токсичні медіатори, що супроводжується утворенням вільних радикалів і АФК. Останні пригнічують ендогенні антиоксиданти, що призводить до окиснювального пошкодження клітин легеневої тканини [21].
У пацієнтів із пневмонією, спричиненою коронавірусною інфекцією, в яких розвинувся ГРДС, спостерігається вища, ніж у пацієнтів без ГРДС, кількість нейтрофілів. Можливо, це зумовлено активацією нейтрофілів для виконання реалізації імунної відповіді проти вірусу, але водночас призводить до так званого цитокінового шторму [8].
Припускають, що вірус починає другу атаку, спричиняючи погіршення стану, приблизно через 7-14 днів після початку захворювання. Від появи перших симптомів COVID-19 до розвитку ГРДС у середньому минає 8 діб [22].
Розвиток інфекції, асоційованої з вірусом SARS-CoV-2, супроводжується надмірною активацією клітинного імунітету. Також у хворих на COVID-19 спостерігається високий уміст прозапальних CCR6+ Th17-клітин.
Можливо, надмірна активація Th17-клітин і надзвичайно високий рівень цитотоксичності CD8+ Т-клітин лежать в основі тяжкості імунного ушкодження легеневої тканини. Крім того, у хворих спостерігається виснаження пулу Тreg-клітин, що зумовлює необмежену активацію механізмів запалення та віддаляє розрішення запального процесу [18].
Ураження серцево-судинної системи
Інфікування вірусом SARS-CoV-2 може пригнічувати активність експресії AПФ-2, що призводить до токсичного надмірного накопичення ангіотензину II, яке спричиняє ГРДС і міокардит [23].
Ушкодження міокарда, асоційоване з інфікуванням вірусом SARS-CoV-2, що супроводжувалося різким підвищенням концентрації тропоніну I (>28 пг/мл), спостерігалося в 5 з перших 41 пацієнта з діагнозом COVID-19 у м. Ухані, Китай [24].
У понад 60% хворих, які померли від COVID-19, в анамнезі відзначалися артеріальна гіпертензія, серцево-судинні захворювання чи діабет [25].
Є припущення, що блокада ренін-ангіотензинової системи збільшує експресію AПФ-2, зумовлюючи інтерналізацію SARS-CoV-2 у клітини легень і серця, що призводить до ГРДС, міокардиту та смерті [26].
Інші можливі механізми ушкодження міокарда включають «цитокіновий шторм», спричинений дисбалансом відповіді Тh1- і Тreg-клітин, і гіпоксемію, спричинену COVID-19 [27].
Гіперкоагуляція та тромбоз
Окрім респіраторних симптомів (пневмонія та ГРДС), у більшості критичних хворих відзначаються тяжкі системні прояви захворювання й поліорганної недостатності. Саме тому багато пацієнтів із COVID-19 не реагують адекватно на респіраторну підтримку. Один із найбільш значущих проявів, пов’язаних із поганим прогнозом, – розвиток коагулопатії й ендотеліальної дисфункції з дифузним мікро- та макротромбозом. При цьому найбільше вражаються легені – через найвищий рівень запалення.
Саме цим обґрунтовується думка про те, що не варто рано переводити хворих на штучну вентиляцію легень (ШВЛ), оскільки без адекватного кровотоку в них це є марним. Основна ідея вентиляції – в поліпшенні оксигенації, для чого необхідне оптимальне співвідношення вентиляції та перфузії, а також збереження механізму венозної гіпоксичної вазоконстрикції. Насправді 9 із 10 хворих помирають від серцево-судинних, а не респіраторних причин, оскільки саме венозний мікротромбоз, а не пневмонія, визначає летальність, а в значної частки хворих пусковим механізмом дихальної недостатності є тромбоз і ендотеліальна дисфункція [8].
Низка повідомлень указують на високу частоту як артеріальних, так і венозних тромбоемболічних ускладнень у пацієнтів із COVID-19, що свідчить про необхідність використання простих і доступних лабораторних маркерів. Частота венозної тромбоемболії може сягати 25%, інколи призводячи до смерті. У хворих спостерігається підвищена частота виникнення інфарктів, інсультів та інших тромботичних захворювань.
Серед гематологічних змін відзначають підвищення вмісту D-димеру, фібриногену й інших запальних маркерів. На відміну від класичного ДВС-синдрому в цих хворих ступінь збільшення активованого часткового тромбопластинового часу часто є меншим, аніж подовження протромбінового часу (ймовірно, через підвищений рівень фактора VIII). ДВС-синдром може розвиватися на подальших стадіях хвороби, зумовлюючи погіршення прогнозу. Зважаючи на критичну роль тромбозапалення й ендотеліальної дисфункції в умовах «цитокінового шторму» на ранніх етапах хвороби слід застосовувати протизапальні препарати [28].
Підходи до лікування пацієнтів із COVID-19 та її ускладненнями
Оскільки не існує загальновизнаного схваленого методу лікування нової коронавірусної інфекції, фахівці змушені використовувати препарати, не зареєстровані як лікарські засоби для терапії саме COVID-19, щоби полегшити симптоми пацієнтів. Тобто склалася ситуація, за якої вагомішого значення, ніж принципи доказової медицини, набуває практичний клінічний досвід [29].
З огляду на те що наразі немає етіотропної терапії з доведеною ефективністю, підходи до лікування пацієнтів із COVID-19 мають включати патогенетичну, симптоматичну та замісну терапію.
У настанові Всесвітньої організації охорони здоров’я від 13 березня 2020 р. зазначено, що лікування легкої форми COVID-19 має включати симптоматичну терапію та моніторинг; при тяжкій формі необхідні киснева терапія, моніторинг і лікування коінфекції. Пацієнти в критичному стані потребують додаткових заходів для лікування ГРДС і септичного шоку та профілактики ускладнень [1].
У близько 15% дорослих, інфікованих SARS-CoV-2, розвивається тяжка пневмонія, що потребує додаткової інсуфляції кисню. У 5% хворих перебіг пневмонії прогресує до критичного рівня з розвитком гіпоксемічної дихальної недостатності, ГРДС і поліорганної недостатності, що потребують респіраторної підтримки, часто протягом декількох тижнів [30].
Пневмонія, зумовлена COVID-19, характеризується збільшенням умісту ефекторних Т-клітин, запальних цитокінів і D-димеру, активацією коагуляційного каскаду, підвищенням рівня фіброзу та мікроемболією, що необхідно брати до уваги при виборі терапевтичної стратегії.
Оскільки системне та легеневе запалення, що загрожує життю, розвивається швидко, важливим є раннє виявлення клінічних і гуморальних маркерів, реактивної гіперімунної відповіді. Тому вчасний початок лікування може кардинально вплинути на ефективність терапії та мінімізувати можливий вплив вірусної реплікації [31, 32].
Синдромно-патогенетичний підхід
Обираючи схему лікування пацієнтів із COVID-19, слід пам’ятати про мінімізацію наслідків із метою зменшення частоти інвалідизації та зниження якості життя тих, хто переніс це тяжке захворювання. Серед можливих наслідків виокремлюють такі:
- передусім соматичні порушення: мікротромбоендотеліїт – системне ураження судин з утворенням мікротромбів, у результаті чого страждають дихальна, видільна, серцево-судинна, ендокринна, гастроентерологічна системи тощо; фіброзні зміни легеневої тканини, пневмосклероз. Відновити прохідність легень допомагають медикаментозні методики (бронхо- та муколітики, стероїди), інтрапульмональна перкусійна вентиляція. У пацієнтів із цукровим діабетом, судини котрих, особливо дрібні, вже зазнали ураження, необхідно корегувати терапію цукрознижувальними препаратами;
- наслідки лікування небезпечними препаратами: гастроентерологічні ускладнення за COVID-19 – це переважно печінкова недостатність, значною мірою пов’язана з лікарським впливом;
- загострення хронічних хвороб, зміна характеру їх перебігу, що потребує корекції;
- психологічні проблеми, розвиток депресії.
Формування комплексу реабілітаційних заходів має виходити з конкретної ситуації. Надзвичайної актуальності набуває застосування синдромно-патогенетичного підходу, що полягає в лікуванні не діагнозу, а його конкретних проявів, синдромів. Наприклад, за ураження ендотелію в легенях відбувається переміщення плазми в міжтканинний простір, надалі утворюються гіалінові мембрани, відбувається процес фіброзування. Утім, навіть якщо фіброзні зміни зберігаються тривалий час, необхідно керуватися синдромним підходом: забезпечувати кисневу підтримку та неінвазивну вентиляцію легень лише за дихальної недостатності. Тим більше що застосування апаратів ШВЛ у разі COVID-19 асоційоване з високою (до 90%) смертністю, вентилятор-асоційованими пневмоніями й іншими ускладненнями [33].
Методи фармакотерапії COVID-19
Серед лікарських засобів, які використовують для боротьби з COVID-19, – противірусні препарати (як у монотерапії, так і в різних комбінаціях, включаючи інтерферони). Наприклад, розроблений для комбінованого лікування пацієнтів із ВІЛ нелфінавір включено до списку потенційно ефективних препаратів для терапії COVID-19 [34].
Є також дані щодо ефективності препарату ремдесивір, який діє безпосередньо на збудник коронавірусної інфекції: його застосування сприяло поліпшенню стану 68% пацієнтів, скорочуючи тривалість перебування в стаціонарі з 15 до 11 днів [35].
Фавіпіравір, який раніше застосовували для лікування грипу, а нині успішно використовують як експериментальний засіб терапії COVID-19, діє на одну з ланок реплікації вірусної РНК, сприяючи зниженню частоти летальних результатів удвічі, а серйозних ускладнень – у 4 рази [36, 37].
Дані щодо застосування в пацієнтів із COVID-19 препаратів на основі хлорохіну (іноді в комбінації з антибіотиком азитроміцином) є суперечливими: противірусну дію ці засоби чинять у високих концентраціях, що призводить до проявів токсичності; крім того, серйозним небажаним ефектом їх застосування є серцева аритмія [38].
Значний інтерес викликає застосування препаратів рекомбінантних людських моноклональних антитіл до рецепторів ІЛ-6 – левілімабу й тоцилізумабу, а також інших засобів, що викликають імуносупресію, запобігаючи надмірно активній імунній відповіді, котра може призвести до погіршення клінічного стану. Так, тоцилізумаб блокує рецептори ІЛ-6, що сприяє позитивному терапевтичному ефекту при багатьох запальних захворюваннях, включаючи COVID-19 [39]. Ретроспективне дослідження ефективності застосування тоцилізумабу при лікуванні пацієнтів із COVID-19 у тяжкому чи критичному стані показало, що препарат сприяв поліпшенню оксигенації в 75% хворих і нормалізації кількості периферичних лімфоцитів у 52,6% [40].
Пацієнти з ослабленим імунітетом можуть бути більш схильними до ускладнень COVID-19 через відсутність швидкої імунологічної відповіді, що допомагає подолати вірус. Однак наразі є припущення, що імуносупресія здатна відігравати й захисну роль у разі інфікування COVID-19, запобігаючи надмірно активній імунній відповіді, котра інколи призводить до погіршення клінічного стану, чи послаблюючи її [41].
Зокрема, описано випадок виснаження В-клітин, за якого розвинувся COVID-19 без серйозних ускладнень у пацієнта, котрий страждав на розсіяний склероз, бронхіальну астму та виразкову хворобу. Автори публікації припускають, що персистенція В-клітин у вторинних лімфоїдних органах, пов’язана з помірно зниженою імунною відповіддю через відсутність периферичних В-клітин, могла відіграти сприятливу роль. Те, що в пацієнта не спостерігалося значного збільшення вмісту ІЛ-6 (який може вивільнятися периферичними В-клітинами), ймовірно, свідчить на користь цієї гіпотези. У разі її підтвердження більшою кількістю випадків можна буде припустити, що пацієнти, котрі зазнають виснаження В-клітин, набувають захисту від серйозних ускладнень COVID-19. Це свідчитиме на користь застосування селективних імунодепресантів за серйозних випадків COVID-19 [42].
Оскільки активність у тканинах легень ферменту гіалуронансинтази-2 призводить до надлишку продукції гіалуронової кислоти, є думка, що пригнічення її продукції сприятиме збільшенню поверхні газообміну в альвеолах і одужанню хворих на COVID-19. Зокрема, з цією метою пропонується застосовувати схвалений для лікування дисфункції жовчного міхура препарат гімекромон, який є інгібітором гіалуронансинтази-2 [13].
Згідно з останніми клінічними повідомленнями, період терапевтичного діапазону при COVID-19 значно довший за 14 днів, але тривалий вплив вірусу може призводити до раптових інтенсивних імунологічних реакцій, «цитокінового шторму» й інфільтрації імунними клітинами. Деякі імуноцити, особливо макрофаги та нейтрофіли, здатні продукувати численні АФК [43, 44].
Певний рівень АФК важливий для регулювання імунологічних реакцій і для очищення від вірусів, але їх надмірний уміст призводить до окиснення клітинних білків і мембранних ліпідів, а також швидкого руйнування не тільки заражених вірусом, але й нормальних клітин легень і навіть серця, в результаті чого розвивається поліорганна недостатність. Тож антиоксидантна терапія може бути запропонована як потенційний терапевтичний підхід для зменшення ураження тканин легень і серцево-судинної системи, спричинених COVID-19. Серед потенційних препаратів називають такі антиоксиданти, як вітамін С (аскорбінова кислота) та вітамін Е, оскільки їхні відновлювані атоми водню можуть вступати в реакцію з АФК і нейтралізувати їх без утворення токсичних речовин. Згадують також молекули рослинного походження (використовувані в давньокитайській медицині), такі як куркумін і байкалін [45].
Передбачається, що належна доза антиоксидантів може сприяти зменшенню ушкоджень серця та легень у пацієнтів із тяжкими формами COVID-19, але науковці не виключають, що такий підхід може бути корисним і для пацієнтів із легкими симптомами захворювання [46].
Можливості застосування едаравону, L-аргініну, L-карнітину та Реосорбілакту в комплексній терапії пацієнтів із COVID-19
Потенційна користь антиоксидантної терапії залежить від правильного вибору лікарських препаратів. Ключовими вимогами до них є здатність впливати на мітохондріальну проникність, блокувати сигнальні шляхи початку запалення (ІЛ-1, -6, -18), діяти в синергізмі з водорозчинними антиоксидантами (в цитоплазмі).
Едаравон
Едаравон – низькомолекулярний антиоксидантний засіб, який цілеспрямовано взаємодіє з пероксильними радикалами. Завдяки своїй амфіфільності він поглинає як жиро-, так і водорозчинні пероксильні радикали, передаючи радикалу електрон; пригнічує окиснення ліпідів шляхом поглинання водорозчинних пероксильних радикалів, що ініціюють ланцюгові хімічні реакції, а також жиророзчинних пероксильних радикалів, які підтримують цей ланцюг [47].
У 2001 р. цей препарат був схвалений в Японії як лікарський засіб для терапії гострого ішемічного інсульту, а у 2015 р. – для лікування бічного аміотрофічного склерозу. У рекомендаціях японських товариств із застосування респіраторної підтримки й інтенсивної терапії едаравон зазначений як препарат, який доцільно застосовувати для лікування пацієнтів із ГРДС у відділеннях інтенсивного лікування [52].
Едаравон здатний швидко нейтралізувати широкий спектр вільних радикалів. Він активує eNOS і може поліпшити кровообіг, блокує запальну iNOS; ефективно гальмує перекисне окислення ліпідів (ПОЛ), захищаючи клітини від руйнування завдяки пригніченню ланцюгової реакції ПОЛ шляхом поглинання пероксильних радикалів. Едаравон активує ферменти антиоксидантного захисту SOD (супероксиддисмутазу), CAT (каталазу), GSH-Rx (глутатіонпероксидазу). Препарат легко проникає крізь гематоенцефалічний бар’єр, на відміну від інших акцепторів вільних радикалів, що пояснює його виражений лікувальний ефект; захищає ендотелій головного мозку від пошкодження за рахунок захисного ефекту для мікросудин, що зумовлює його можливий терапевтичний вплив при розладах і захворюваннях, пов’язаних із карбонільним стресом [48].
Едаравон зменшує пошкодження гематоенцефалічного бар’єра та гальмує розвиток набряку мозку, прямо й опосередковано зменшує продукування прозапальних цитокінів: ІЛ-6, iNOS, ФНП, металопротеїназ. Едаравон уже протягом майже 20 років застосовується для лікування пацієнтів з інсультом (протягом перших 24 год), але завдяки своїм властивостям скевенджера вільних радикалів чинить захисну дію на серце, легені, кишечник, печінку, підшлункову залозу, нирки й інші органи. Нещодавно було продемонстровано, що едаравон корисний для пацієнтів із гострим інфарктом міокарда. Препарат також сприяв збільшенню фракції викиду лівого шлуночка та зниженню частоти повторних госпіталізацій пацієнтів із гострим інфарктом міокарда. У дослідженнях на тваринних моделях було показано, що едаравон знижував кількість ІЛ-1β-позитивних клітин міокарда в щурів з експериментальним автоімунним міокардитом; захищав серцеву функцію та зменшував розмір інфаркту шляхом зменшення продукції ФНП у міокарді [49].
В експериментальних дослідженнях було показано, що едаравон здатний запобігати розвитку підвищеної проникності ендотеліоцитів мікроциркуляторного русла легень, спричинену прозапальними цитокінами, ймовірно, завдяки посиленню адгезивних контактів, а також інших механізмів. Отож препарат може бути корисним для лікування пацієнтів із ГРДС і пневмонією в умовах клінічної практики. Безпечність едаравону доведено в низці досліджень [50, 51].
Отже, застосування едаравону – препарату, що здатний ефективно «гасити цитокінову пожежу», – може сприяти значному поліпшенню стану пацієнтів із COVID-19, патогенез якої пов’язаний із розвитком ГРДС і різким збільшенням умісту цитокінів.
L-аргінін
L-аргінін являє собою умовно незамінну амінокислоту, що є активним клітинним регулятором численних життєво важливих функцій організму, виявляючи протекторні ефекти, важливі за критичного стану. Аргінін чинить антигіпоксичну, мембраностабілізувальну, цитопротекторну, антиоксидантну, антирадикальну, дезінтоксикаційну дії. Ця амінокислота – субстрат для синтезу NO й завдяки цьому поліпшує мікроциркуляцію, сприяє міцній вазодилатації, запобігає активації й адгезії лімфоцитів і тромбоцитів. Фізіологічна дія NO варіює від модуляції судинної системи до регуляції імунних процесів (клітинно-опосередкований імунітет, вплив нейтрофілів на патогенні мікроорганізми, неспецифічний імунний захист) і контролю нейрональних функцій. L-аргінін відновлює вміст NO в легеневій тканині, що зменшує спазм непосмугованої мускулатури бронхів і поліпшує вазомоторну функцію ендотелію легеневих артерій [53].
L-аргінін ефективно сприяє зниженню артеріального тиску в пацієнтів з артеріальною гіпертензією [54]. В умовах, коли вакцина проти COVID-19 тільки розробляється, а універсального ефективного лікування не існує, постає питання: яким чином можна забезпечити уникнення ураження? Особливо актуальним воно є для осіб похилого віку та медично скомпрометованих пацієнтів. На думку спеціалістів, перспективним є застосування препаратів, які сприяють загальному зміцненню організму та поліпшують захисну здатність імунітету. До таких речовин, безумовно, належить L-аргінін [55]. Доцільність такого підходу підтверджує розпочате в Медичному центрі Університету штату Огайо, США, клінічне випробування з використанням інгаляційного NO для лікування пацієнтів, у яких діагностовано COVID-19. Метою є уникнення інтенсивної терапії [56].
Отже, збільшення вмісту NO є перспективним напрямом лікування пацієнтів із коронавірусною інфекцією, а L-аргінін може успішно застосовуватися для досягнення цієї мети.
L-карнітин
L-карнітин є природною речовиною, що бере участь в енергетичному метаболізмі, а також метаболізмі кетонових тіл. Він необхідний для транспортування в мітохондрії довголанцюгових жирних кислот (які використовуються як енергетичний субстрат усіма тканинами, за винятком мозку) для їх подальшого β-окиснення й утворення енергії.
Ця речовина відіграє важливу роль у серцевому метаболізмі, оскільки окиснення жирних кислот залежить від наявності його достатньої кількості. Доведено позитивну дію L-карнітину за гострої та хронічної ішемії, декомпенсації серцевої діяльності, серцевої недостатності, спричиненої міокардитом, медикаментозної кардіотоксичності.
Імуномодулювальний ефект L-карнітину полягає в пригніченні прозапальних цитокінів ФНП, ІЛ-6 та ІЛ-1 в умовах «цитокінового шторму». Препарат є прямим антиоксидантом, запобігає апоптозу клітин, чинить кардіопротекторний ефект.
Результати двох масштабних метааналізів – DiNicolantonio (2013) та Askarpour і співавт. (2019) – підтверджують ефективність терапії L-карнітином у пацієнтів із серцево-судинними захворюваннями завдяки зменшенню смертності, поліпшенню якості життя, зниженню рівня холестерину, нормалізації серцевого ритму, зменшенню потреби в нітратах [57, 58].
L-карнітин може бути корисним для пацієнтів із COVID-19 завдяки його імуномодулювальному впливу та пригніченню медіаторів запалення, зокрема СРБ, ФНП та ІЛ-6, що може сприяти зменшенню «цитокінового шторму» [59].
Реосорбілакт
Реосорбілакт – унікальний гіперосмолярний кристалоїдний розчин, який не містить надлишку хлору, а отже, позбавлений основного недоліку таких розчинів – зростання ризику розвитку гіперхлоремії. Важливою відмінністю препарату Реосорбілакт є поєднання як гіперосмолярних властивостей, так і властивостей збалансованих кристалоїдів (набір необхідних іонів Са2+, К+, Na+, Mg2+ в ізоплазматичній концентрації). Завдяки гіперосмолярності Реосорбілакт спричиняє перехід рідини з міжклітинного сектора в судинне русло, що покращує мікроциркуляцію та перфузію тканин завдяки потужному осмодіуретичному ефекту сорбітолу, пов’язаному з відсутністю в людини природних механізмів реабсорбції багатоатомних спиртів у проксимальних ниркових канальцях. Реосорбілакт має виражену діуретичну та протинабрякову дії [60].
Основними фармакологiчно активними речовинами препарату є сорбiтол i натрiю лактат. Сорбiтол поліпшує мікроциркуляцію та перфузію тканин, чинить дезагрегантну дію.
Натрiю лактат сприяє корекції метаболічного ацидозу; натрію хлорид чинить регідратальну дію, поповнює дефіцит іонів натрію та хлору за різних патологічних станів; кальцію хлорид відновлює вміст іонів кальцію, необхідних для здійснення передачі нервових імпульсів, скорочення скелетних і непосмугованих м’язів, діяльності міокарда, формування кісткової тканини, згортання крові, запобігає розвитку запальних реакцій, підвищує стійкість організму до інфекцій; калію хлорид відновлює водно-електролітний баланс, чинить негативну хроно- та батмотропну дію, помірну діуретичну дію.
У низці досліджень виявлено, що застосування гіпертонічного розчину в пацієнтів із геморагічним шоком унаслідок травми знижує тривалість перебування на ШВЛ. Установлено також, що застосування гіперосмолярних розчинів у терапії хворих на тяжкий сепсис дає змогу зменшити об’єм інфузії. Такі позитивні ефекти, як зменшення частоти легеневих ускладнень, тривалості перебування на ШВЛ, об’єму інфузії, є важливими й перспективними при застосуванні гіперосмолярних розчинів у хворих на пневмонію, зокрема спричинену COVID-19, коли важливо дотримуватися рестриктивного режиму інфузії [61, 62].
Мета випробування
Зважаючи на викладене вище, нами було проведено дослідження ефективності синдромно-патогенетичного підходу. Метою було оцінити вплив комбінації препаратів едаравон (Ксаврон), L-аргініну гідрохлорид + L-карнітин (Тіворель) і Реосорбілакт (сорбiтол, натрію лактат, натрію хлорид, кальцію хлорид, калію хлорид, магнію хлорид) на перебіг пневмоній середньої тяжкості, спричинених COVID-19, як доповнення до базисної терапії в умовах пульмонологічного відділення.
Дизайн випробування
У дослідження увійшли дві групи по 30 пацієнтів кожна з діагнозом пневмонії середнього ступеня тяжкості, спричиненої COVID-19. Основна група як доповнення до базисної терапії отримувала комбінацію препаратів едаравон (Ксаврон) 30 мг 2 р/добу довенно, L-аргініну гідрохлорид + L-карнітин (Тіворель) 1 флакон/добу довенно та Реосорбілакт 200 мл/добу. Група контролю отримувала базисну терапію.
Контрольні точки
Досліджуваними показниками були: кількість ліжко-днів, проведених у стаціонарі, сатурація (насичення крові киснем), температура тіла, рівень феритину, D-димеру, СРБ, прокальцитоніну; загальний клінічний аналіз крові з визначенням кількості еритроцитів, лейкоцитів, тромбоцитів, ШОЕ, лейкоцитарної формули, вмісту гемоглобіну. Також пацієнтам виконувалася комп’ютерна томографія органів грудної клітки.
Біохімічний аналіз крові не дає специфічної інформації, але виявлені відхилення можуть вказувати на наявність органної дисфункції, декомпенсацію супутніх захворювань і розвиток ускладнень; мають прогностичне значення, вказують на ефективність вибору лікарських засобів.
Вміст феритину. Гіперферитинемію називають маркером тяжкого перебігу коронавірусної інфекції, асоційованим із високим ризиком розвитку «цитокінового шторму». Зазначається, що дослідники в усьому світі шукають спосіб швидко знижувати рівень феритину в крові таких пацієнтів.
Вміст D-димеру, що в 3-4 рази вищий порівняно з віковою нормою, має клінічне значення.
Вміст СРБ є основним лабораторним маркером активності процесу в легенях; його підвищення корелює з обсягом ураження легеневої тканини та є підставою для початку протизапальної терапії.
Лімфо- та тромбоцитопенія. У більшості пацієнтів із COVID-19 кількість лейкоцитів є нормальною; в одної третини виявляється лейкопенія, а у 83,2% – лімфопенія; тромбоцитопенія має помірний характер, але частіше трапляється в пацієнтів із тяжким перебігом захворювання.
Лабораторними ознаками «цитокінового шторму» та ГРДС можуть бути: раптове наростання клінічних проявів через 1-2 тиж від початку захворювання; фебрильна лихоманка, що наростає чи з’явилася знову; виражена лімфопенія в загальному аналізі крові; зменшення кількості Т- і В-лімфоцитів; значне підвищення рівня D-димеру (>1500) або його швидке наростання; підвищення вмісту СРБ >75 мг/л. Розвиток серцево-судинних ускладнень у разі COVID-19 також супроводжується лімфо- та тромбоцитопенією, підвищенням рівня СРБ.
Результати й обговорення
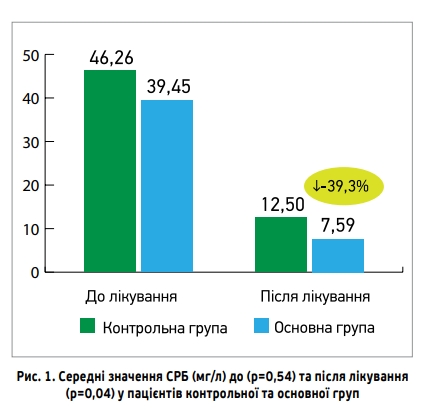
На рисунку 1 показані середні значення вмісту СРБ (мг/л) до та після лікування в пацієнтів основної та контрольної груп. Якщо до лікування різниця між показниками була статистично недостовірною (39,45±9,7 проти 46,26±5,53 мг/мл відповідно), то після лікування в пацієнтів основної групи показник значущо поліпшився порівняно з контрольною групою (7,59±1,71 проти 12,5±1,67 мг/мл відповідно; p=0,04).
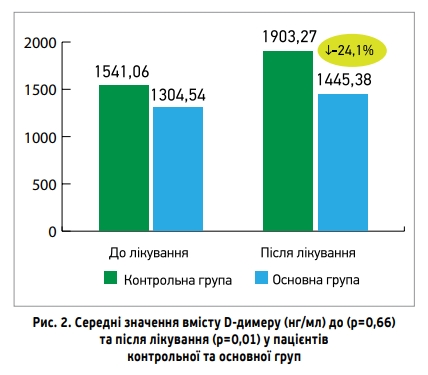
На рисунку 2 показано середні значення вмісту D-димеру (нг/мл) до та після лікування в пацієнтів основної та контрольної груп. До початку лікування різниця між показниками була статистично недостовірною (1304,54±230,32 проти 1541,06±477,79 нг/мл відповідно), після лікування в пацієнтів основної групи показник значущо поліпшився порівняно з контрольною групою (1445,38±106,03 проти 1903,27±129,68 нг/мл; p=0,01).
На рисунку 3 показано середні значення вмісту феритину (нг/мл) до та після лікування в пацієнтів основної та контрольної груп. До початку лікування різниця між показниками була статистично недостовірною (500,6±89,14 проти 598±94,03 нг/мл відповідно), після лікування в пацієнтів основної групи показник значущо поліпшився порівняно з контрольною групою (393,72±51,73 проти 540,11±49,93 нг/мл відповідно; p=0,05).
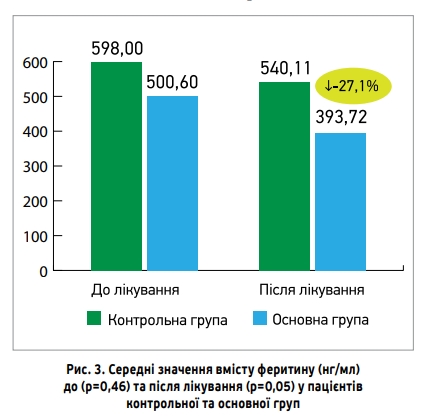
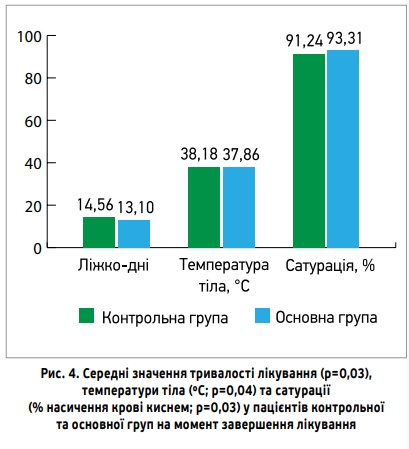
Рисунок 4 дає можливість порівняти середні значення тривалості лікування, температури тіла та сатурації в пацієнтів основної та контрольної груп. Усі показники на момент завершення лікування були значущо кращими в пацієнтів основної групи (поєднання основної терапії з додатковим лікуванням препаратами Ксаврон, Тіворель і Реосорбілакт), аніж у контрольній групі: сатурація становила 93,31±0,57 проти 91,24±0,77 (% насичення крові киснем; p=0,03), температура тіла – 37,86±0,1 проти 38,18±0,12 ( o С; p=0,04), кількість ліжко-днів у стаціонарі – 13,1±0,49 проти 14,56±0,42 (p=0,03) відповідно.
Висновки
- Результати дослідження показали, що в основній групі (пацієнти котрої разом з основною терапією пневмонії, спричиненої COVID-19, отримували додаткову терапію препаратами Ксаврон, Тіворель і Реосорбілакт) достовірно поліпшилася низка показників порівняно з контрольною групою (лише основна терапія). Додаткове лікування сприяло поліпшенню насиченості крові киснем, зниженню температури тіла, а також скороченню перебування пацієнтів у стаціонарі.
- На момент завершення лікування в основній групі достовірно знизилася концентрація СРБ – маркера активності запального процесу в легенях, підвищення рівня котрого корелює з обсягом ураження легеневої тканини й тяжкістю перебігу захворювання.
- Зменшення вмісту D-димеру, котрий теж належить до маркерів запального процесу, в пацієнтів основної групи свідчить про поліпшення їхнього стану порівняно з контрольною групою.
- Збільшення концентрації гострофазового білка феритину відзначають у разі несприятливого перебігу захворювання й так званого цитокінового шторму, тобто зниження зазначеного показника в основній групі є доказом ефективності додаткової терапії препаратами Ксаврон, Тіворель і Реосорбілакт.
- Нині приділяється особлива увага застосуванню синдромно-патогенетичному підходу в лікуванні коронавірусної інфекції, оскільки етіотропні лікарські засоби, що діють безпосередньо на збудник COVID-19, іще не розроблені. У цих умовах надзвичайно важливим є використання комплексного підходу в лікуванні пацієнтів із тяжкими формами захворювання, за якого будуть враховані індивідуальні особливості та забезпечена максимально ефективна підтримка організму. Слід також робити все можливе для запобігання інвалідизації та зниженню якості життя пацієнтів після перенесеної хвороби через можливі ускладнення (ураження респіраторної системи внаслідок фіброзу, тяжкі наслідки для серцево-судинної системи через тромбоутворення тощо). Цьому сприятиме додаткове застосування препаратів Ксаврон, Тіворель і Реосорбілакт.
Перспективи подальших досліджень
Встановлено, що, крім пневмоній, COVID-19 супроводжується розвитком дихальної недостатності, змінами реологічних і фібринолітичних властивостей крові, підвищеним тромбоутворенням, ураженням серцево-судинної та нервової систем, підвищеним фіброзоутворенням у легенях. У ході дослідження була відзначена тенденція до зменшення проявів фіброзу легень в основній групі. Тому доцільно було би дослідити вплив запропонованої нами комбінації препаратів на процеси фіброзоутворення в легенях після перенесених вірусних пневмоній, зважаючи на широкий спектр уже відомих лікувальних властивостей цих засобів.
Автор статті: С.В. Коваленко, д.м.н., кафедра внутрішньої медицини, клінічної фармакології та професійних хвороб Буковинського державного медичного університету; пульмонологічне відділення Чернівецької обласної клінічної лікарні.
Опубліковано: Медична газета «Здоров'я України», № 13-14 (482-483), Липень 2020