ЮРіЯ-ФАРМ запустила социальный проект «Уверенный путь к выздоровлению – Ксаврон против инсульта»
ЖИЗНЬ – это главная земная ценность и ключевой миссией ЮРіЯ-ФАРМ является сохранять и улучшать ее! ЮРіЯ-ФАРМ, как Корпорация с высоким уровнем социальной ответственности, беспокоится о качестве жизни и состоянии здоровья пациентов с острым ишемическим инсультом, потому запустила социальный проект «Уверенный путь к выздоровлению – Ксаврон против инсульта», который продлится до сентября 2024 года включительно. Цель […]
Влияние Эдаравона на атрофию мышц и опорно-двигательную функцию у пациентов с ишемическим инсультом (рандомизированное контролируемое пилотное исследование)
Предпосылки и цель: Пациенты с инсультом и тяжелым параличом ног часто оказываются прикованы к постели в острой и подострой фазе заболевания, что увеличивает риск возникновения мышечной атрофии в хронической фазе. Имеющиеся на сегодняшний день данные указывают на то, что оксидативный стресс играет важную роль в механизме атрофии бездействующих мышц. Таким образом, целью данного исследования было определить, […]
Опубликовано: Drugs R D 2010; 10 (3)
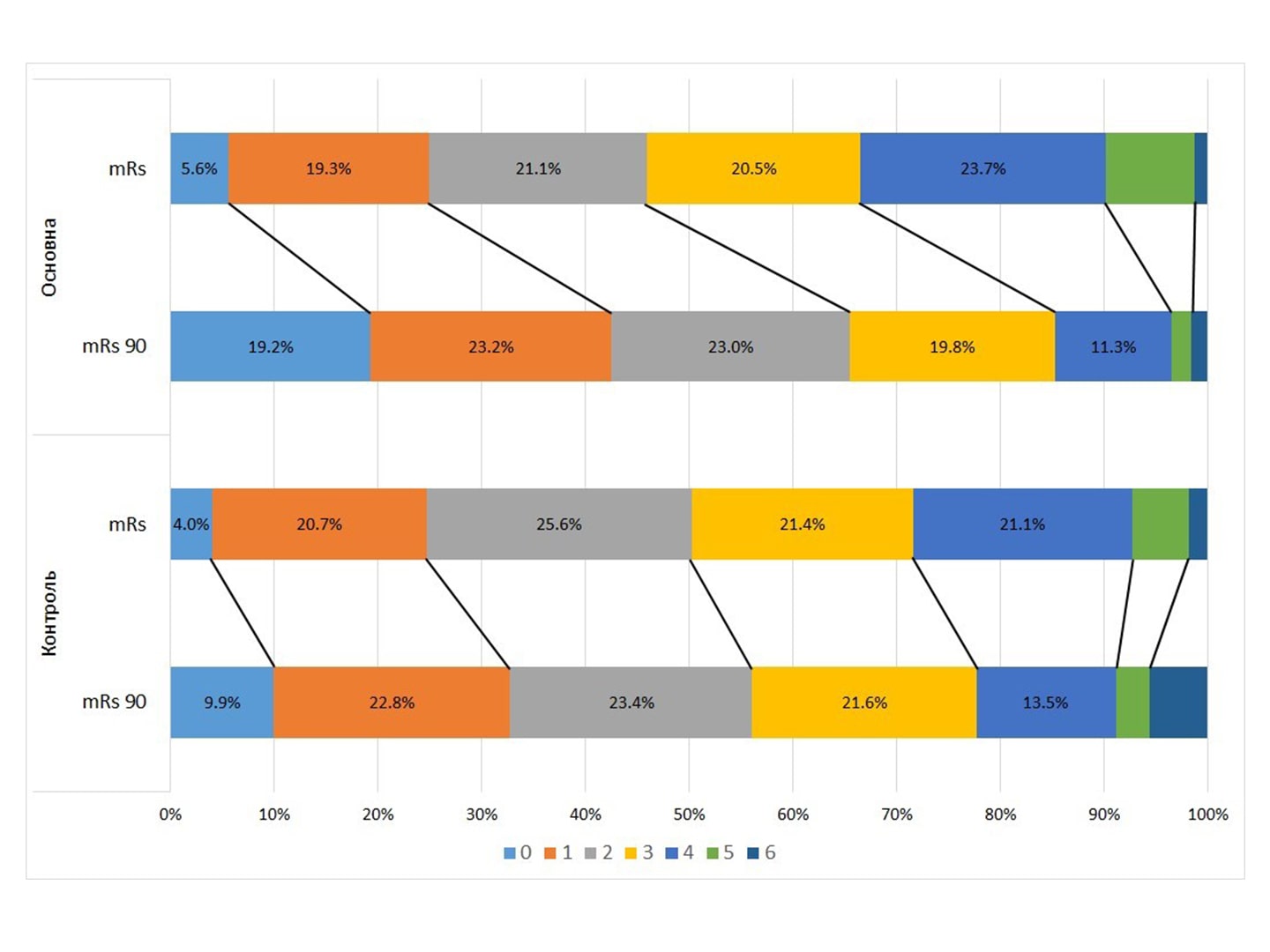
Окончательная оценка результатов исследования СТИКс (Сопутственная Терапия Инсульта Ксавроном)
Резюме. Ишемический инсульт остается актуальной проблемой сегодняшнего дня. Его патогенез состоит из последовательного каскада реакций в мозге, которые в дополнение к ишемии отвечают за дальнейшее повреждение мозговой ткани и замедляют развитие компенсаторных и регенеративных механизмов. Попытки прервать патологический каскад длятся несколько десятилетий. Первой перспективной молекулой, продемонстрировавшей в доклинических исследованиях потенциал скавенджера (уборщика, поглотителя) избыточных агрессивных перекисей, […]
Опубликовано: Международный неврологический журнал, том 17, № 5, 2021
Сосудистые неврологические осложнения у пациентов с COVID-19
В статье рассмотрены современные взгляды на развитие и течение коронавирусной инфекции COVID-19. Особое внимание уделено сосудистым неврологическим осложнениям. С целью оптимизации лечения цереброваскулярных осложнений у пациентов с сопутствующим COVID-19 применяли эдаравон и комбинацию цитиколина с электролитами. Проанализированы клинические и параклинические данные 34 пациентов. Доказано, что указанная комбинация лекарственных средств может быть рекомендована для широкого применения […]
Опубликовано: УКР. МЕД. ЖУРНАЛ, 2 (142) - III / IV 2021
Новые возможности фармакотерапии пациентов с острым ишемическим инсультом
Вашему вниманию представлен обзор статьи M. Kaste et al. «Safety, Tolerability and Pharmacokinetics of MCI-186 in Patients with Acute Ischemic Stroke: New Formulation and Dosing Regimen», опубликованной в издании Cerebrovascular Diseases (2013; 36: 196-204), посвященной анализу результатов исследования безопасности, переносимости и фармакокинетики новой схемы введения и режима дозирования эдаравона у пациентов с острым ишемическим инсультом. […]
Опубликовано: НЕЙРОNEWS, 6 (117) '2020, ст. 46-49
Промежуточные результаты исследования СТИКс (Сопутствующая Терапия Инсульта Ксавроном) — открытого многоцентрового исследования «случай — контроль»
В статье приведены результаты первого этапа исследования СТИКс — открытого многоцентрового исследования «случай — контроль». Промежуточный анализ результатов (interim analysis) дает возможность убедиться в тенденциях в пользу рабочей гипотезы, позволяет вовремя оценить недостатки созданного протокола и соответствует требованиям академического и медицинского сообществ в прозрачности обнародования результатов. Всего за период с марта по сентябрь 2020 года […]
Опубликовано: THE JOURNAL OF NEUROSCIENCE of B.M. Mankovskyi’ 2021, VOLUME 9, № 1
Применение препаратов эдаравона, цитиколина и электролитов, L-аргинина у пациентов с острым нарушением мозгового кровообращения
В статье представлены результаты применения цитопротекторной терапии, примененной в дополнение к традиционному лечению пациентов с острым нарушением мозгового кровообращения. Актуальним напрямом у лікуванні пацієнтів із ГПМК є застосування цитопротекторів, які можуть бути ефективним доповненням до тромболізису. Ці засоби захищають ішемізовані нейрони та нейросудинні одиниці від незворотних ушкоджень, посилюють нейропластичність і сприяють процесу відновлення нервової тканини. […]
Опубликовано: Нейроnews 9 (120), 2020
ЯПОНСКОЕ РУКОВОДСТВО ПО ЛЕЧЕНИЮ ИНСУЛЬТА 2015, ДОПОЛНЕННОЕ В 2017 ГОДУ.
Рекомендации: Эдаравон препарат с ожидаемым нейропротекторными эффектом, рекомендован в качестве лекарственного средства для пациентов с ишемическим инсультом головного мозга (тромбоэмболией) (степень В).
Опубликовано: Международный неврологический журнал, №1 (103), 2019
Уход и лечение в остром периоде инсульта: необходимое, достаточное, границы дозволенного.
Актуальность работы: публикация содержит обзор основных положений для организации ухода за пациентами в остром периоде инсульта, основанные на текущих рекомендациях и лучшем клиническом опыте. Цель публикации: помочь новым инсультным центрам в организации процесса ведения больных, дополнив документальное сопровождение (локальный протокол и маршрут пациента) ключевыми положениями по уходу, для минимизации рисков осложнений и увеличения шансов положительного […]
Кохрановская база данных систематических обзоров. Эдаравон для лечения острого ишемического инсульта.
Данные экспериментальных и клинических исследований показали, что эдаравон может быть полезным для пациентов с острым ишемическим инсультом. Цель обзора: оценить эффективность и безопасность эдаравона при остром ишемическом инсульте. Основные результаты. Авторы включили три испытания. Доза инъекций эдаравона в трех испытаниях была одинаковой и составляла 60 мг/сут, а продолжительность курса лечения 14 дней. В группе эдаравона у пациентов […]
Опубликовано: Кохрановская база данных систематических обзоров 2011.
Алгоритмы действий, минимальные условия и составляющие оказания качественной медицинской помощи при остром инсульте
Актуальность работы: лечение острого инсульта требует применения процедуры документального менеджмента, лечебные учреждения имеют разные ресурсы и условия оказания медицинской помощи, в параметры реформы заложены «индикаторы качества предоставления услуг» по принципу их регулярного обнародования, согласно рекомендаций 10-го круглого стола академической науки STAIR остается насущной потребность в цитопротекции и защите нейроваскулярного юнита. Актуальность работы: лечение острого инсульта требует применения […]
Протокол открытого многоцентрового исследования «случай-контроль» …
ПРОТОКОЛ ОТКРЫТОГО МНОГОЦЕНТРОВОГО ИССЛЕДОВАНИЯ «СЛУЧАЙ-КОНТРОЛЬ» ЭФФЕКТИВНОСТИ И БЕЗОПАСНОСТИ ПРИМЕНЕНИЯ ЭДАРАВОНА (КСАВРОН®) В ОСТРОМ ПЕРИОДЕ ИШЕМИЧЕСКОГО ИНСУЛЬТА В УСЛОВИЯХ РЕАЛЬНОЙ КЛИНИЧЕСКОЙ ПРАКТИКИ На украинском фармакологическом рынке появился препарат класса скавенджеров (утилизаторов) активных радикалов и перекисных соединений. Речь идет о препарате Ксаврон производства «Юрия-Фарм», действующим веществом которого является эдаравон. Эдаравон получил одобрение FDA для лечения БАС (боковой […]
Опубликовано: Медицинская газета «Здоровье Укаины». Спецвыпуск «Инсульт» № 1 (52), 2020 р.