Вирус SARS-CoV-2 имеет тропизм к клеткам центральной нервной системы и может вызывать развитие неврологической симптоматики у инфицированных пациентов. В этом отношении введение в схему интенсивной терапии препарата Ксаврон® (эдаравон) может быть целесообразным исходя из его особенностей уменьшать проявление не только оксидативного стресса, но и явлений «цитокинового шторма» в виде значительного уменьшения интерлейкина-6, тем самым купируя не только проявление неврологических симптомов, но и уровня системно-воспалительного ответа.
В январе 2020 года Всемирная организация здравоохранения объявила вспышку эпидемии, связанной с вирусом SARS-CoV-2, чрезвычайной ситуацией в области здравоохранения международного значения, и уже 11 марта 2020 года количество жертв, связанных с инфицированием данным вирусом, дало основания охарактеризовать сложившуюся ситуацию, как пандемию [1].
В январе 2020 года Всемирная организация здравоохранения объявила вспышку эпидемии, связанной с вирусом SARS-CoV-2, чрезвычайной ситуацией в области здравоохранения международного значения, и уже 11 марта 2020 года количество жертв, связанных с инфицированием данным вирусом, дало основания охарактеризовать сложившуюся ситуацию, как пандемию [1].
Исследования показали, что SARS-CoV-2 эффективно передается от человека к человеку. По состоянию на 08.12.2020 года, в мире зарегистрировано 67,956,925 случаев заболеваний коронавирусной инфекцией [2]. При этом, общее количество летальных случаев составило 1,550,562 человек. Таким образом, процент общей летальности достиг 2,28% [2].
Отличительной особенностью данного заболевания является его «стремительная» распространенность. И в связи с большим количеством инфицированного населения, к настоящему времени уже подробно описаны клинические проявления COVID-19 [3].
По мере накопления клинического опыта, все больше появляется работ, которые открывают новые данные о проявлениях этого вирусного заболевания и последствиях, которые могут влиять, как на изменение клинической картины, так и на качество жизни переболевших COVID-19 [3]. Основываясь на первичных данных, полученных из больниц Ухани, исследования выявили наиболее распространенные симптомы COVID-19 – лихорадку (83% — 99% случаев) и сухой кашель (59,4% — 82% случаев) [4,5,6]. Однако наиболее характерным симптомом заболевания является дыхательная недостаточность (выявляется в 55% случаев) [4,5,6]. Как сообщили авторы этих исследований, среди пациентов с одышкой более половины нуждались в интенсивной терапии. При этом, приблизительно от 46% до 65% таких больных за короткий период времени погибли из-за дыхательной недостаточности [4,5,6].
Среди пациентов, которые были госпитализированы в отделение интенсивной терапии (ОИТ), у 11,1% проводилась кислородная терапия с высоким потоком, 41,7% получали неинвазивную вентиляцию легких и 47,2% были переведены на искусственную вентиляцию [5]. Эти данные свидетельствуют о том, что большинство (около 89%) пациентов, поступивших в ОИТ, нуждались в проведении интенсивной кислородной поддержки, или вспомогательной/инвазивной вентиляции легких [5]. Однако авторы данных работ не сообщали о каких-либо неврологических проявлениях у пациентов с COVID-19.
Впервые неврологические проявления SARS-CoV-2 были описаны Ling Mao и соавт., которые выявили характерную неврологическую симптоматику у 78 из 214 пациентов с лабораторно подтвержденным диагнозом COVID-19 в больницах, расположенных в эпицентре Ухани [7]. Как указывают авторы данной работы, у 36,4% пациентов были выявлены неврологические проявления. При этом, пациенты с более тяжелой симптоматикой имели бóльший процент неврологических симптомов (45,5% против 30,2%) [7]. Цереброваскулярные проявления заболевания также чаще встречались у пациентов с более тяжелым клиническим течением (5,7% против 0,8%). [7].
Позже выяснилось, что изменение обоняния или вкуса является типичным признаком коронавирусной инфекции. Более тщательно эти клинические проявление изучили Spinato G. и соавт., которые выявили, что гипогевзия и гипосмия встречаются у 34% пациентов с COVID-19 [8]. Также следует отметить, что данный симптом являлся ранним проявлением заболевания у 11,9% инфицированных пациентов, у 22,8% он регистрировался одновременно с другой симптоматикой, а у 26,7% выявлялся в отсроченном периоде, позже появление других симптомов заболевания [8]. Данные факты нацелили исследовательские работы на выявление нейроинвазивных механизмов инфицирования при COVID-19. Так Chatterjee P. и соавт., описали несколько путей проникновения вируса SARS-CoV-2 в центральную нервную систему (ЦНС), которые включали трансневральный и гематогенный пути инвазии [9]. Коронавирус, как было описано в данных исследованиях, достигает центральных мозговых структур через обонятельную луковицу, распространяясь из этой точки в ЦНС [9,10]. Этот путь является отличительным механизмом достижения ЦНС для коронавирусов, попадающих в организм интраназально. Обонятельный нерв связан с носовым эпителием, а также с обонятельной луковицей, которая является анатомическим «входом» вируса в ЦНС [11].
Подтверждением данной теории является исследования, проведенное St-Jean J.R. и соавт., в котором на экспериментальных моделях животных было продемонстрировано, что удаление обонятельного нерва ограничивает нейротропную способность вируса у мышей. Было также доказано, что после интраназального введения инокулята вируса лабораторным животным, инфекция распространялась в ЦНС менее чем за 7 дней. К тому же, при исследованиях глиальных структур было обнаружено, что вирус может вызывать демиелинизацию нервных волокон [12].
Более ранние исследования образцов взятых у пациентов с SARS в начале 2002 и 2003 годов продемонстрировали присутствие частиц SARS-CoV в головном мозге, где они располагались почти исключительно в нейронах [13-15]. Экспериментальные исследования с использованием трансгенных мышей показали, что SARS-CoV и MERS-CоV, при их интраназальном введении могут проникать в мозг, а затем быстро распространяться в определенные его области, включая таламус и ствол мозга [16,17]. Примечательно, что у мышей, инфицированных низкими дозами инокулята, частицы вируса MERS-CоV также были обнаружены в головном мозге, что по мнению исследователей и явилось результатом высокой смертности лабораторных животных в данной группе [17]. Исследователи особо отметили, что сильнее всего при этом был инфицирован и поражен именно ствол головного мозга [16,17].
В этом отношении интерес представляет работа Ceccarelli M. и соавт., которые сообщают, что вирусные антигены были обнаружены в стволе мозга, где инфицированные области включали ядро одиночного тракта и двойное ядро [18]. А как известно, эфферентные волокна двойного ядра и ядра одиночного тракта обеспечивают иннервацию гладких мышц дыхательных путей и кровеносных сосудов. Такие нейроанатомические взаимосвязи указывают на то, что смерть инфицированных животных или пациентов из-за респираторной недостаточности может быть вызвана дисфункцией данных мозговых структур [18].
В свете большого сходства между SARS-CoV и SARS-CoV-2 вполне вероятно, что SARS-CoV-2 также обладает аналогичным потенциалом. Если обратить внимание на данные эпидемиологических исследований COVID-19, которые указывают на то, что среднее время от проявления первых симптомов заболевания до появления одышки составляет в среднем 5,0 дней, до госпитализации – в среднем 7,0 дней, а развитие тяжелой степени дыхательной недостаточности определяется в среднем через 8,0 дней, и учесть скорость коронавирусной нейроинвазии полученной у лабораторных животных (7 дней), то вполне вероятно предположить, что латентного периода может быть достаточно, чтобы вирус проник в нейроны мозгового слоя и разрушил их [5]. Следовательно, настороженность о возможной нейроинвазии может иметь решающее значение для профилактики и лечения дыхательной недостаточности, вызванной SARS-CoV-2 [19].
Сообщения о более тяжелых неврологических проявления COVID-19 появились в апреле 2020 года, когда Moriguchi T. и соавт. опубликовали клинический случай менингита, связанного с SARS-CoV-2. В ходе обследования пациента был выполнен ряд обследований, в том числе МРТ головного мозга, которое показала гиперинтенсивность вдоль стенки правого бокового желудочка и гиперинтенсивные изменения в правой височной доле и гиппокампе, что указывало на возможность менингита, вызванного SARS-CoV-2 [20].
Частота другого неврологического проявления, а именно энцефалопатического делирия, при COVID-19 всё еще остается неясной. Так, по мнению Kotfis К. и соавт., ранние сообщения о его возникновении у 25% пациентов с COVID-19, вероятно, являются серьезной недооценкой, которая происходит всякий раз, когда делирий просто не диагностируется [21]. Целый ряд работ, посвященных этому вопросу доказывает, что около 75% случаев делирия у пациентов пропускаются, если только не используется объективный мониторинг делирия для выявления этой формы острой дисфункции головного мозга [22-24].
Действительно, пациенты с COVID-19 подвержены повышенному риску делирия из-за, по крайней мере, семи факторов, включая прямую инвазию центральной нервной системы, индукцию высвобождения медиаторов воспаления в ЦНС, вторичное повреждение нервной системы, эффект седативных препаратов, продление времени искусственной вентиляции легких, длительную иммобилизацию и другие неблагоприятные факторы, включая социальную изоляцию [21].
Воспалительный ответ ЦНС на вирусную инфекцию, по-видимому, является еще одной важной причиной возникновения неврологической симптоматики и делирия. Через несколько часов после заражения SARS-CoV-2, нейтрофилы и моноциты проникают в ЦНС, и, как утверждает ряд авторов, нарушают проницаемость гематоэнцефалического барьера [25,26]. Посмертное исследование, проведенное Gu J. и соавт., документально подтвердило массивную инфильтрацию мозга иммунными клетками с развитием «цитокинового шторма», которая была связана с отеком нейронов головного мозга [27].
Так как вирусная инфекция вызывает «цитокиновый шторм», включая выброс хемокинов, интерферон-индуцируемого белка IP-10, интерферона β и интерлейкина-6 (IL-6), что приводит к гибели клеток, наиболее важным лекарственным средством в этом отношении являются антиоксиданты, т.к. активированные формы кислорода (АФК) играют решающую роль в воспалительной реакции и вспышке цитокинов. Как указывает в своей работе Zhong-Wei Zhang и соавт., при острых заболеваниях, вызванных взрывом АФК, проницаемые для митохондрий антиоксиданты следует использовать уже на ранней стадии [28].
В Японии у пациентов с острым церебральным инфарктом (тромбоз/эмболия) одобрено использование поглотителя свободных радикалов – эдаравона который подавляет развитие ишемических цереброваскулярных расстройств (отек головного мозга, медленная гибель нейронов), путем связывания свободных радикалов и уменьшения окисного повреждения клеток мозга. Как показали исследования Ikeda S. и соавт., эдаравон уменьшал площадь инфаркта головного мозга и способствовал функциональному восстановлению гемипареза при церебральном тромбозе в модели на лабораторных крысах [30]. По мнению Hashimoto S. и соавт., использование данного препарата обоснованно тем, что количество свободных радикалов постепенно увеличивается в областях, окружающих ишемическую область, и также быстро увеличиваются после реперфузии [29].
Более ранние исследования действия эдаравона на цитокин-индуцированную гиперпроницаемость легочных микрососудистых эндотелиальных клеток показало, что при его применении наблюдалось снижение сосудистой проницаемости на 45%, которая была нарушена вследствие «цитокинового шторма». Тогда как при использовании дексаметазона, она снижалась на 35% [31].
Учитывая литературные данные о патогенетической составляющей коронавирусной инфекции и свойствах эдаравона в плане способности эффективно воздействовать на системно-воспалительные реакции, мы провели пилотное исследование, направленное на изучение использование данного препарата у пациентов с SARS-CoV-2.
Материалы и методы. В пилотном исследовании приняло участие 16 пациентов, которые были разделены на 2 равномерные группы: 1 группа – пациенты, которым проводилось лечение согласно протоколам МОЗ Украины по предоставлению медицинской помощи для лечения коронавирусного заболевания COVID-19 [32,33] (группа контроля); 2 группа – пациенты, которым помимо стандартной терапии, в схему лечения был добавлен препарат Ксаврон® (эдаравон производства ООО «Юрия-Фарм») 30 мг в/в 2 раза в сутки на период 7-10 дней. Контрольными точками исследования были 1, 2, 3-4, 7, 10 и 14 сутки после начала лечения.
Демографические данные, а также данные о лечении, сопутствующих заболеваниях, лабораторных показателях и клинических исходах были получены из историй болезней пациентов. У всех пациентов был подтвержденный диагноз COVID-19 с помощью полимеразной цепной реакции. В исследование вошло 5 мужчин и 7 женщин. Возраст пациентов обеих групп исследования составлял 60,1±10,6, вес – 65,5±8,7. Средняя температура тела при поступлении фиксировалась на уровне +37,5±5,2°С, а насыщение артериальной крови кислородом по пульсоксиметру 73,5±7,6%.
Сформированные группы не имели статистически достоверных гендерных отличий и совпадали по клиническим проявлениям заболевания.
Для контроля состояния пациентов обеих групп, определялись основные биохимические показатели, указывающие на системную воспалительную реакцию, такие как уровень С-реактивного белка, фибриногена и IL-6. Также для определения тяжести состояния и прогноза исходов пациентов использовалась шкала NEWS 2 [34]. Данная шкала учитывает частоту дыхания (в мин.), частоту сердечных сокращений (в мин.), систолическое артериальное давление (мм рт ст.), насыщение артериальной крови кислородом (%), потребность в кислородной поддержке, уровень сознания по шкале AVPU (A – Alert (в сознании, соответствует 15 баллам по шкале ком Глазго), V – Voice (реакция на голос), P – Pain (реакция на боль), U – Unresponsive (отсутствие реакции)), температуру тела (°С).
Критериями исключения пациентов из исследования были: наличие почечной и печеночной недостаточности; сопутствующие тяжелые заболевания сердца, печени и почек в анамнезе; возраст старше 70 лет; наличие онкологических заболеваний в анамнезе.Результаты и обсуждение. Как видно из представленных на рис.1 данных, между двумя группами исследования не было выявлено разницы в показателях шкалы NEWS на первые сутки после начала терапии (р=0,71524). Однако уже на 7 сутки, в группе пациентов с применением эдаравона (Ксаврон®), данный показатель был на 42,8% меньше, относительно аналогичных значений у пациентов контрольной группы (р=0,00137) (рис.1). К концу исследуемого периода (14-е сутки пребывания в стационаре), показатели оценки тяжести состояния пациентов исследуемой группы были на 23,8% меньше относительно группы контроля (р=0,00241), что являлось серьезным прогностическим показателем используемой терапии.
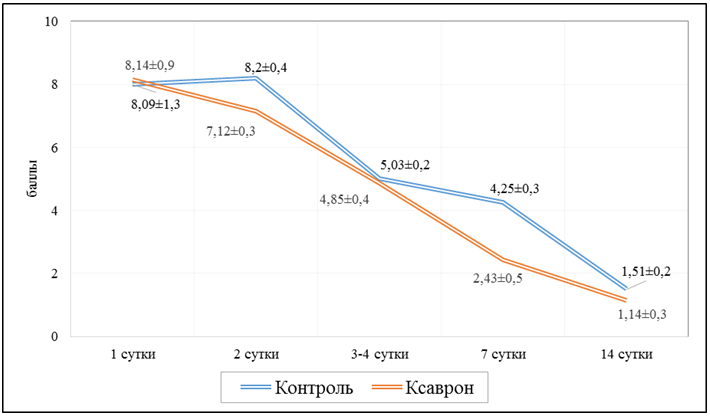
Рис.1. Оценка тяжести пациентов по шкале NEWS 2.
Как было доказано в многочисленных исследованиях, одним из центральных звеньев патогенетического повреждения при коронавирусной инфекции является нарушение системы коагуляции. В нашем исследовании с 10-х суток в группе контроля уровень фибриногена начал повышаться и к 14 дню разница с аналогичными значениями, которые были получены у пациентов исследуемой группы, составляла в среднем 34,9% (р=0,002147) (рис.2).
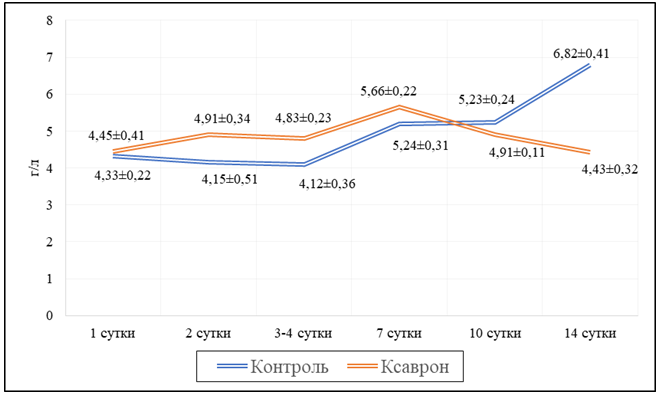
Рис.2. Показатели уровней фибриногена среди пациентов двух групп исследования.
Основным медиатором при развитии неконтролируемой системной воспалительной реакции у пациентов с SARS-CoV-2 является уровень IL-6. Именно поэтому в ходе нашего исследования была выполнена количественная оценка данного показателя. При поступлении в стационар, в обеих группах исследования определялось повышение уровня IL-6 в среднем на 96,3±12,4% от референсных значений (N= 0 — 4,1 пг/мл). По мере развития клинической симптоматики, мы наблюдал значительный рост показателей IL-6 в контрольной группе и умеренное повышение относительно средних значений при поступлении в исследуемой группе с эдаравоном (Ксаврон®). Уровень IL-6 имел тенденцию к меньшим показателям в группе исследования уже с 3-х суток (р<0,05). К 10-м суткам разница между этими показателями составляла в среднем 28,75±2,43%, а к 14-м – 45,42±4,28%. Причем, следует отметить, что в группе контроля к даже к 14-м суткам его уровень оставался стабильно высоким (рис.3).
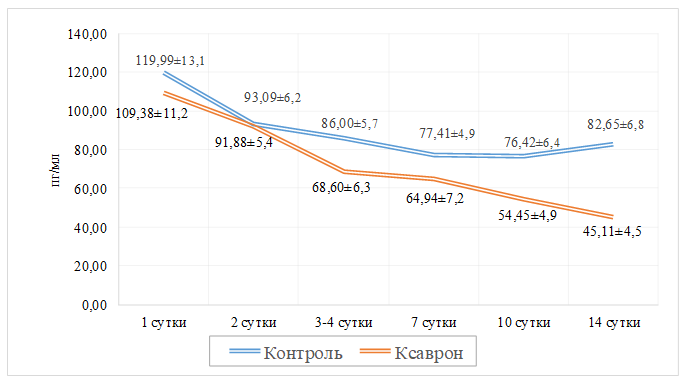
Рис.3. Показатели уровней IL6 среди пациентов двух групп исследования.
Средние показатели уровня IL-6 в контрольной группе составили 55,896±23,44 пг/мл (от 5,11 до 165,9 пг/мл), что соответствовало повышению уровня в среднем на 1363,32±147,2% относительно верхних значений референсных значений (рис.4).
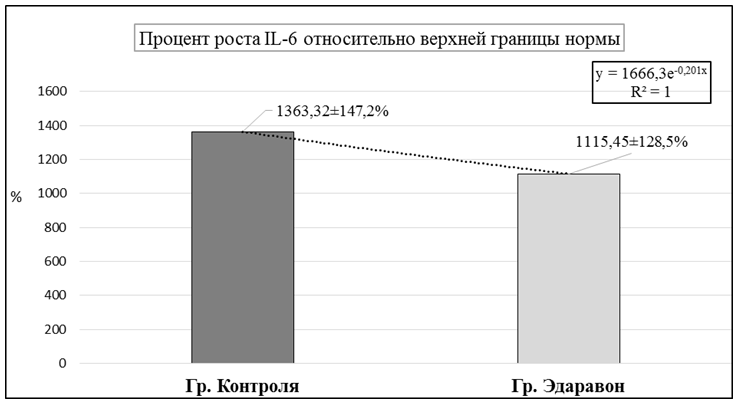
Рис.4. Влияние эдаравона на манифестацию IL-6 у пациентов с COVID-19.
Средние показатели уровня IL-6 в группе исследования с использованием эдаравона (Ксаврон®) составили 45,7335±16,21 пг/мл (от 1,77 до 288,4 пг/мл), что соответствовало повышению уровня в среднем на 1115,45±128,5% относительно верхней границы референсных значений, что было на 18,2±3,1% меньше, относительно аналогичных показателей, зафиксированных в контрольной группе (рис.4).
При этом следует отметить, что в группе исследования с использованием эдаравона (Ксаврон®) повышение уровня IL-6 в среднем до 68,69±27,3 пг/мл (макс. 288,4 пг/мл) отмечалось только у трех пациентов (37,5% случаев). У остальных 62,5% случаев, манифестация IL-6 определялась как умеренная. Тогда, как в контрольной группе рост показателей IL-6 (макс. 165,9 пг/мл) был зафиксирован у всех обследованных пациентов – 100% случаев. У остальных пациентов группы исследования рост уровня IL-6 составлял в среднем 75,78±12,5% (среднее знач.= 3,11 пг/мл; макс. знач.= 6,72 пг/мл; мин. знач.= 1,77 пг/мл).
Летальность у пациентов контрольной группы фиксировалась на уровне 12,5% (1 пациент), в группе исследования с использованием эдаравона (Ксаврон®) летальные случаи отсутствовали.
Заключение. Проведенный анализлитературных источников показал, что вирус SARS-CoV-2 имеет тропизм к клеткам центральной нервной системы и может вызывать развитие неврологической симптоматики у инфицированных пациентов. В этом отношении введение в схему интенсивной терапии препарата Ксаврон® (эдаравон) производства компании «Юрия-Фарм») может быть целесообразным исходя из его особенностей уменьшать проявление не только оксидативного стресса, но и явлений «цитокинового шторма» в виде значительного уменьшения интерлейкина-6, тем самым купируя не только проявление неврологических симптомов, но и уровня системно-воспалительного ответа.
Список литературы.
1. https://www.who.int
2. https://www.worldometers.info/coronavirus/
3. Comparative tropism, replication kinetics, and cell damage profiling of SARS-CoV-2 and SARS-CoV with implications for clinical manifestations, transmissibility, and laboratory studies of COVID-19: an observational study / H.Chu, J.F. Chan, T.T. Yuen, [et al] // Lancet Microbe. – 2020. – Vol.1(1). – Р.14-23.
4. Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China / C. Huang, Y. Wang, X. Li, [et al] // Lancet. – 2020. – Vol.395 (Issue 10223). – Р. 497‐506.
5. Clinical characteristics of 138 hospitalized patients with 2019 novel coronavirus‐infected pneumonia in Wuhan, China / D. Wang, B. Hu, C. Hu, [et al] // JAMA. – 2020. – Vol.323(11).– Р.1061-1069.
6. Epidemiological and clinical characteristics of 99 cases of 2019 novel coronavirus pneumonia in Wuhan, China: a descriptive study / N. Chen, M. Zhou, X. Dong, [et al] // Lancet. – 2020. – Vol.395(10223). – Р. 507‐513.
7. Neurological Manifestations of Hospitalized Patients with COVID-19 in Wuhan, China: a retrospective case series study / Ling Mao, Mengdie Wang, Shanghai Chen, Quanwei He. // JAMA Neurol. – 2020. – Vol.77(6). – Р. 683-690.
8. Alterations in Smell or Taste in Mildly Symptomatic Outpatients With SARS-CoV-2 Infection / G. Spinato, C. Fabbris, J. Polesel, [et al] // JAMA. – 2020. – Vol. 323(20). – Р. 2089 — 2090.
9. The 2019 novel coronavirus disease (COVID-19) pandemic: A review of the current evidence / P. Chatterjee, N. Nagi, A. Agarwal, [et al] // Indian J Med Res. – 2020. – Vol.151(2 & 3). – Р. 147-159.
10. Foley J.E. A review of coronavirus infection in the central nervous system of cats and mice / J.E. Foley, C. Leutenegger // J Vet Intern Med. – 2001. – 15(5). – Р. 438-444.
11. Effectiveness of olfactory training on different severities of posttraumatic loss of smell / R. Pellegrino, P. Han, N. Reither, [et al] // Laryngoscope. – 2019. – Vol.129 (8). – Р. 1737- 1743.
12. Human respiratory coronavirus OC43: genetic stability and neuroinvasion / J.R. St-Jean, H. Jacomy, M. Desforges, [et al] // J Virol. – 2004. – Vol.78(16). – Р. 8824-8834.
13. Organ distribution of severe acute respiratory syndrome (SARS) associated coronavirus (SARS‐CoV) in SARS patients: implications for pathogenesis and virus transmission pathways / Y. Ding, L. He, Q. Zhang, [et al] // J Pathol. – 2004.– Vol.203(2). – Р. 622‐630.
14. Multiple organ infection and the pathogenesis of SARS / J. Gu, E. Gong, B. Zhang,
[et al]
// J Exp Med. – 2005. – Vol.202(3). – Р. 415‐424.
15. Detection of severe acute respiratory syndrome coronavirus in the brain: potential role of the chemokine mig in pathogenesis / J. Xu, S. Zhong, J. Liu, [et al] // Clin Infect Dis. – 2005. – Vol.41(8). – Р. 1089‐1096.
16. Severe acute respiratory syndrome coronavirus infection causes neuronal death in the absence of encephalitis in mice transgenic for human ACE2 / J. Netland, D.K. Meyerholz, S. Moore, [et al] // J Virol. – 2008. – Vol.82(15). – Р. 7264‐7275.
17. Middle East respiratory syndrome coronavirus causes multiple organ damage and lethal disease in mice transgenic for human dipeptidyl peptidase 4 / K. Li, C. Wohlford‐Lenane, S. Perlman, [et al] // J Infect Dis. – 2016. – Vol. 213(5) – Р. 712‐722.
18. Differences and similarities between Severe Acute Respiratory Syndrome (SARS)- CoronaVirus (CoV) and SARS-CoV-2. Would a rose by another name smell as sweet? / M. Ceccarelli, M. Berretta, E. Venanzi Rullo, [et al] // Eur Rev Med Pharmacol Sci. – 2020. – Vol. 24(5). – Р. 2781-2783.
19. The neuroinvasive potential of SARS-CoV2 may play a role in the respiratory failure of COVID-19 patients / Y.C. Li, W.Z. Bai, T. Hashikawa // Journal of Medical Virology.– 2020. – Vol. 92(6). – Р. 552-555.
20. A first case of meningitis/encephalitis associated with SARS-Coronavirus-2 / T. Moriguchi, N. Harii, J. Goto, [et al] // Int J Infect Dis. – 2020. – Vol. 94. – Р. 55-58.
21. COVID-19: ICU delirium management during SARS-CoV-2 pandemic / K. Kotfis, S. Williams Roberson, J.E. Wilson, [et al] // Crit Care. – 2020. – Vol.24(1). – Р. 176.
22. Comparison of delirium assessment tools in a mixed intensive care unit / M.M. van Eijk, R.J. van Marum, I.A. Klijn, [et al] // Crit Care Med. – 2009.– Vol.37(6) –Р. 1881 — 1885.
23. Occurrence of delirium is severely underestimated in the ICU during daily care / P.E. Spronk, B. Riekerk, J. Hofhuis, [et al] // Intens Care Med. – 2009. – Vol. 35(7). – Р. 1276 — 1280.
24. Screening, detection and management of delirium in the emergency department — a pilot study on the feasibility of a new algorithm for use in older emergency department patients: the modified Confusion Assessment Method for the Emergency Department (mCAM-ED) / F.F. Grossmann, W. Hasemann, A. Graber, [et al] // Scand J Trauma Resusc Emerg Med. – 2014. – Vol. 22. – Р. 19.
25. Neutrophils promote mononuclear cell infiltration during viral-induced encephalitis / J. Zhou, S.A. Stohlman., D.R. Hinton, [et al] // Immunol. –2003. – Vol.170 (6). – Р. 3331 — 3336.
26. Maturation and localization of macrophages and microglia during infection with a neurotropic murine coronavirus / S.P. Templeton, T.S. Kim, K. O’Malley, [et al] // Brain pathology. – 2008. – Vol.18(1). – Р. 40-51.
27. Multiple organ infection and the pathogenesis of SARS / J. Gu, E. Gong, B. Zhang,
[et al]
// J Exp Med. – 2005. – Vol. 202(3). – Р. 415=424.
28. Mitochondrion-Permeable Antioxidants to Treat ROS-Burst-Mediated Acute Diseases / Zhong-Wei Zhang, Xiao-Chao Xu, Ting Liu, [et al] // Oxidative Medicine and Cellular Longevity. – Vol.2016, Published online 2015.
29. The clinical practice guideline for the management of ARDS in Japan / S. Hashimoto, M. Sanui, M. Egi, [et al] // J Intensive Care. – 2017. – Vol.5. – Р.50.
30. Effects of edaravone, a free radical scavenger, on photochemically induced cerebral infarction in a rat hemiplegic model / S. Ikeda, K. Harada, A. Ohwatashi,
[et al]
// Scientific World Journal. – 2013. – Published online 2013 Jun 17.
31. Inhibitory Effects of Edaravone, a Free Radical Scavenger, on Cytokine-induced Hyperpermeability of Human Pulmonary Microvascular Endothelial Cells:A Comparison with Dexamethasone and Nitric Oxide Synthase Inhibitor / Y. Saito, Y. Fujii, M. Yashiro, [et al] // Acta Med Okayama. – 2015. – Vol. 69(5). – Р. 279-90.
32. https://moz.gov.ua/uploads/5/26129-dn_2106_17_09_2020_dod_1.pdf
33. https://moz.gov.ua/article/ministry-mandates/nakaz-moz-ukraini-vid-17092020—2116pro-vnesennja-zmin-do-protokolu—nadannja-medichnoi-dopomogi-dlja-likuvannja—koronavirusnoi-hvorobi-covid-19
34. https://www.rcplondon.ac.uk/projects/outputs/national-early-warning-score-news-2
Опубликовано: Спецвыпуск «Инсульт», 2021 р. Здоровье Украины