Повышенная легочная проницаемость играет роль в развитии острого респираторного дистресс-синдрома (ОРДС), однако на данный момент не существует доказанных терапевтических стратегий по контролю проницаемости микроциркуляторного русла. Мы исследовали эффекты эдаравона, дексаметазона и N-монометил-L-аргинина (L-NMMA) на изменения проницаемости эндотелиоцитов микроциркуляторного русла легких человека (PMVEC — pulmonary microvascular endothelial cells) при гиперцитокинемии. Человеческие PMVEC были засеяны в камеру Бойдена. После достижения монослоя в результате слияния питательные среды были заменены соответственно на эдаравон-, дексаметазон- и L-NMMA-содержащие культуральные среды. После 24-часовой инкубации монослой простимулировали фактором некроза опухолей-α (TNF-α) и интерлейкином-1β (IL-1β). Был добавлен меченый флуоресцеином декстран. После этого была измерена утечка трансчеловеческих PMVEC. Экспрессию сосудисто-эндотелиального кадгерина (VE-кадгерина) и белка zonula occludens-1 (ZO-1) определяли при помощи количественной полимеразно-цепной реакции в режиме реального времени и иммунофлюоресцентной микроскопии. Результаты показали, что TNF-α + IL-1β заметно повышали проницаемость микроциркуляторного русла легких. При предварительной обработке эдаравоном, дексаметазоном или L-NMMA наблюдалось снижение повышенной проницаемости и подавление снижения экспрессии VE-кадгерина при иммунофлюоресцентном закрашивании. Эдаравон и дексаметазон усиливали экспрессию ZO-1 и на уровне мРНК, и на белковом уровне. Эдаравон и дексаметазон замедляли изменения проницаемости человеческих PMVEC, во всяком случае, частично в результате стимуляции VE-кадгерина. В целом, полученные результаты указывают на возможность применения такого терапевтического подхода у пациентов с ОРДС.
Инфекция, вызванная вирусом гриппа, может привести к развитию тяжелой пневмонии, особенно у детей и взрослых с сопутствующими заболеваниями [1, 2]. Многим пациентам необходима вентиляционная поддержка в результате тяжелых осложнений, таких как острый респираторный дистресс-синдром (ОРДС) [3]. Есть сообщения о том, что пандемические штаммы вируса гриппа A/H1N1 обладают афинностью к альвеолоцитам ІІ типа и непосредственно проникают в легкие [4]. Хотя и считается, что повышенная проницаемость легких играет роль в развитии ОРДС [5], на данный момент не существует доступных медицинских препаратов с клинически доказанной эффективностью для контроля сосудистой проницаемости.
Сосудисто-эндотелиальные межклеточные контакты, контролирующие сосудистую проницаемость, в основном образованы адгезивными и плотными контактами [6, 7]. Адгезивные контакты образованы представителями белков семейства кадгеринов. Сосудисто-эндотелиальный кадгерин (VE-кадгерин) регулируется системой положительного и отрицательного контроля при помощи различных сигналов. Он динамично регулирует адгезию эндотелиоцитов и барьерную функцию кровеносных сосудов [6, 8]. Тесные контакты состоят из трансмембранных молекул, таких как окклю-дин, клаудин, и молекул адгезии межклеточных контактов. Белок zonula occludens-1 (ZO-1), протеин, покрывающий плотные плотные контакты, объединяет трансмембранные молекулы с актиновым цитоскелетом.
В ответ на провоспалительные цитокины в сосудистом эндотелии происходит экспрессия клеточных молекул адгезии, включая молекулу межклеточной адгезии-1 (ICAM-1) и сосудисто-клеточную молекулу адгезии-1 (VCAM-1), и секреция хемокинов, как то моноцитарного белка хемоатрактанта-1 (MCP-1) и интерлейкина-8 (IL-8), с целью активации миграции лейкоцитов в ткани с воспалением [9].
Согласно существующим данным, эдаравон (3-метил-1-фенил-2-пиразолин-5-он), применяемый в лечении инфарктов головного мозга в роли акцептора свободных радикалов [10], защищает, в том числе, другие органы [11]. Несколько исследований с участием животных продемонстрировали, что эдаравон предупреждает поражение легких, вызванное различными факторами, включая противоопухолевые препараты, липополисахариды, и острый панкреатит за счет своих антиоксидантных и противовоспалительных свойств[12-15]. Несмотря на это, существует очень мало данных о том, оказывает ли эдаравон защитное воздействие на развитие ОРДС при повышенной сосудистой проницаемости.
Во время пандемии инфекции гриппа А в 2009 году частота тяжелых пневмоний и ОРДС вследствие повышенной проницаемости легких значительно превысила частоту таких осложнений, вызванных инфицированием вирусом сезонного гриппа [2, 3]. Хотя поначалу мы пытались провести экспериментальное исследование инфекции гриппа, используя эндотелиоциты микроциркуляторного русла легких человека (PMVEC), однако ни пандемический вирус гриппа A/H1N1, ни вирус A/H3N3Aichi не продемонстрировали способность инфицировать эндотелиоциты или изменять характеристики проницаемости (неопубликованные данные).
Поэтому мы прицельно исследовали изменения проницаемости эндотелиоцитов под воздействием провоспалительных цитокинов, продуцируемых во время тяжелых инфекционных заболеваний, включая грипп. Для этого исследования мы использовали монослойную модель PMVEC человека с целью определения изменений барьера проницаемости, возникающих в эндотелиоцитах при гиперцитокинемии. Существуют сообщения о том, что дексаметазон и ингибитор синтазы оксида азота (NOS) снижают повышенную проницаемость легочных сосудов при ОРДС [16, 17]. Таким образом, мы исследовали терапевтический эффект эдаравона на изменения проницаемости и, при тех же экспериментальных условиях, сравнили эффекты эдаравона с теми же самыми эффектами дексаметазона и ингибитора NOS.
Материалы и методы
Культура клеток. PMVEC человека были приобретены у Lonza Group, Ltd. (Вокерсвилл, Мериленд, США (Walkersville, MD, USA) и хранились в BulletKit (EGM-2MV; Lonza), как рекомендовано производителем. Клетки культивировали при концентрации воздуха 95%, СО2 5% и температуре 37 °C. Все опыты были выполнены на клетках от 3-го до 6-го пассажей.
Анализ проницаемости. Для определения проницаемости использовалась камера Бойдена. Человеческие PMVEC были засеяны на мембранные вставки Transwell (поры 3,0 мкм; Becton, Dickinson and Co., Франклин Лейкс, Нью-Джерси, США (Franklin Lakes, NJ, USA) с концентрацией 5 × 104 клеток/лунку. Клетки культивировали в течение 3 дней. После достижения монослоя в результате слияния питательные среды в верхней камере (150 мкл) и нижней камере (750 мкл) были заменены соответственно культуральными средами, содержавшими эдаравон (100 мкМ; Mitsubishi Tanabe Pharma Corp., Токио, Япония), дексаметазон (100 мкM; Calbiochem Novabiochem Corp., Ла-Хойя, Калифорния, США (La Jolla, CA, USA)), и N-монометил-L-аргинин (L-NMMA, 1 мM; Calbiochem Novabiochem Corp.). После 24-часовой инкубации питательная среда была заменена средой, в которой содержались каждое из веществ и цитокины. Фактор некроза опухолей-α (TNF-α) (Peprotech Inc., Роки Хилл, Нью-Джерси, США (Rocky Hill, NJ, USA)) и интерлейкин-1β (IL-1β) (Peprotech Inc.) были использованы в роли про-воспалительных цитокинов. В ходе ряда предварительных экспериментов PMVEC человека были обработаны исключительно TNF-α (100 нг/мл) или IL-1 β (100 нг/мл) или их комбинацией. Использованные по одному, каждый из цитокинов — TNF-α и IL-1β — показали способность повышать эндотелиальную проницаемость, однако изменения пермеабильности были незначительными. Только комбинация TNF-α + IL-1β достоверно повышала проницаемость (данные не продемонстрированы). Таким образом, в следующих экспериментах PMVEC человека обрабатывались TNF-α + IL- 1β при каждой из 2 концентраций: (10 нг/мл или 100 нг/мл) в течение 24 ч.
В качестве контрольного буфера использовался натрий-фосфатный буфер. Для определения утечки декстрана через трансчеловеческие PMVEС было добавлено по 150 мкл среды для количественного определения с декстраном, меченым флюоресцеин-изотиоцианатом (FITC-Dx; MW 3000) (100#г/мл) в каждую камеру; также в каждую из нижних камер было добавлено по 750 мкл среды для количественного определения. После инкубации в течение 2 часов при температуре 37 °C была измерена интенсивность флюоресценции среды в нижних камерах при длине 485-538 нм. Данные были выражены следующим образом: индекс проницаемости (%) = [(клиренс, полученный в эксперименте) – (спонтанный клиренс)] – 100 / [(клиренс самого фильтра) – (спонтанный клиренс)] [18]. Эксперименты были проведены трижды и каждый раз состояли из 4 параллельных опытов.
Анализ высвобождения лактатдегидрогеназы (ЛДГ). Повреждения клеток определяли при помощи анализа высвобождения ЛДГ (LDH Cytotoxicity Detection Kit; Takara Bio Inc., Шига, Япония (Shiga, Japan)). Процент цитотоксичности исчисляли следующим образом: цитотоксичность (%) = [высвобождение ЛДГ в эксперименте (OD492) – спонтанное высвобождение ЛДГ (OD492)] × 100 / [максимальный уровень высвобождения ЛДГ(OD492)] – [спонтанное высвобождение ЛДГ (OD492)]. Результаты оптической плотности OD492 спонтанного высвобождения ЛДГ и OD492 максимального высвобождения ЛДГ были получены соответственно из супернатанта культуры клеток группы контроля и супернатанта клеток, обработанных 2% Triton X-100. Эксперименты были проведены дважды и каждый раз состояли из 4 параллельных опытов.
Иммунофлюоресцентная микроскопия. Для экспериментов с использованием иммунофлюоресцентных методов были вырощены эндотелиоциты на слайд-камерах, покрытых коллагеном-І (Becton, Dickinson and Co.). Далее они обрабатывались эдаравоном, дексаметазоном или L-NMMA в течение 24 часов, а в дальнейшем — TNF-α + IL-1β (10мкг/мл) еще в течение 24 ч. После этого клетки были промыты натрий-фосфатным буфером и закреплены в 2% растворе альдегида. После пермеабилизации 0,1%Triton X-100 и блокировки клеток провели их инкубацию с анти-VE- антителом (10мкг/мл; R & D Systems, Миннеаполис, Mиннесота, США (Minneapolis, MN, USA)) и анти-ZO-1 антителом (5мкг/мл; Genetex Inc., Ирвин, Калифорния, США (Irvine, CA, USA)) в течение 60 мин. В качестве вторичного антитела было использовано Alexa Fluor 488-конъюгированное антитело (Invitrogen Corp., Карлсбад, Калифорния, США (Carlsbad, CA, USA)). Ядро закрашивали 4’, 6-диамид- ино-2-фенилиндолом (DAPI) в закрепляющей среде (Vectashield; Vector Laboratories Inc., Берлингейм, Калифорния, США (Burlingame, CA, USA)). Исследуемые образцы оценивали при помощи флюоресцентного микроскопа (BZ-9000 generation II; Keyence Co., Осака, Япония). Эксперименты были проведены повторно 4 раза.
Количественная полимеразная цепная реакция в режиме реального времени (ПЦР в режиме реального времени). Для изучения влияния цитокинов и препаратов на мРНК-экспрессию VE-кадгерина и ZO-1 в популяции PMVEC в условиях эксперимента применялась ПЦР в режиме реального времени с полным извлечением РНК из клеток при помощи специфических праймеров, приведенных в таблице 1 [19]. После достижения слияния в 24-луночных планшетах была проведена инкубация клеток в течение 24 часов с добавлением эдаравона, дексаметазона или L-NMMA с дальнейшей обработкой TNF-α + IL-1β. После стимуляции проведено извлечение комплементарной ДНК с использованием FastLane® Cell cDNA (Qiagen Inc., Хильден, Германия (Hilden, Germany). ПЦР в режиме реального времени проводилась при помощи системы ПЦР в режиме реального времени (7500 Fast; Applied Biosystems, Фостер Сити, Калифорния, США (Foster City, CA, USA)) с SYBR ®Premix Ex Taq (Takara Bio Inc.). Смесь для ПЦР, суммарным объемом 50 мкл, состояла из реагента 1 X SYBR ®Premix Ex Taq, содержавшего ДНК-полимеразу, краситель SYBR Green, dNTP-смесь и ПЛР-буфер, по 0,2 мкМ прямого и обратного праймеров, а также исследуемых образцов кДНК. Глицеральдегид-3-фосфатдегидрогеназа (GAPDH) была использована с целью нормализации синтеза кДНК. Результаты получены в 2 разных экспериментальных условиях и в ходе проведения 4 параллельных опытов в каждом из них.

Ферментный иммуносорбентный анализ (ELISA). Определение уровня экспресии молекул адгезии в супернатанте культуры клеток происходило in vitro по модели Леле [20-22]. Уровни растворимых ICAM-1 (sICAM-1) и растворимых VCAM-1 (sVCAM-1) измерялись (анализатор Luminex 100/200 System; Luminex Corp., Остин, Техас, США (Austin, TX, USA)) при помощи диагностической панели Human CVD Panel 1 96-well Plate Assay (Millipore Corp., Бедфорд, Mассачусетс, США (Bedford, MA, USA)). Определение уровней MCP-1 and IL-8 также проводили при помощи ELISA (R & D Systems). Результаты получены в 2 разных экспериментальных условиях с 4 параллельными опытами в каждом из них.
Статистический анализ. Все величины представлены в виде среднего значения ± SD. Отличия между группами были проанализированы на предмет статистической достоверности при помощи одностороннего дисперсионного анализа и критерия множественного сравнения Тьюки. Достоверными считали отличия при значениях р<0,05.
Результаты
Изменение проницаемости монослоя PMVEC человека. Как изображено на рис. 1, эндотелиальная проницаемость значительно росла при влиянии TNF-α + IL-1β при концентрациях 10 нг/мл и 100 нг/мл, по сравнению с контрольной группой. Не наблюдалась достоверная разница между влиянием различных концентраций — 10 нг/мл и 100 нг/мл. Для следующих экспериментов была принята рабочая концентрация 10 нг/мл. При предварительной обработке эдаравоном (100#M) наблюдалось значительное снижение повышенной проницаемости на 45% по сравнению с группой, в которой применяли только TNF-α + IL-1β (Рис. 2A). При предварительной обработке дексаметазоном (100#M) наблюдалось значительное снижение повышенной проницаемости на 35% по сравнению с группой, в которой применяли только TNF-α + IL-1β (рис. 2Б). При предварительной обработке L-NMMA (1 мM) наблюдалось значительное снижение повышенной проницаемости на 50% по сравнению с группой, в которой применяли только TNF-α + IL-1β (Рис. 2В).
Клеточная цитотоксичность. Повреждение клеток оценивали при помощи определения высвобождения ЛДГ. На высвобождение ЛДГ существенно не влияла предварительная обработка культуры эндотелиоцитов эдаравоном, дексаметазоном или L-NMMA по сравнению с группой, в которой применяли только TNF-α + IL-1β (Рис. 3). Это указывает на то, что снижение повышенной проницаемости в данном исследовании при предварительной обработке упомянутыми веществами не было вызвано торможением повреждения клеточной мембраны или гибелью клетки.
Влияние эдаравона, дексаметазона и L—NMMA на экспрессию белка эндотелиальных адгезивных контактов VE—кадгерина. Изучалось влияние эдаравона, дексаметазона и L-NMMA на экспрессию VE-кадгерина с целью определения взаимосвязей между изменениями проницаемости и клеточно-клеточной адгезией. Иммунофлюоресцентное окрашивание показало, что закрашивание VE-кадгерина уменьшалось после стимуляции TNF-α + IL-1β. Предварительная обработка эдаравоном, дексаметазоном или L-NMMA в течение 24 ч ослабляла стимулирующее влияние TNF-α + IL-1β (Рис. 4А — 4Ґ). Предварительная обработка эдаравоном, дексаметазоном или L-NMMA в течение 24 ч с последующим применением TNF-α + IL-1β в течение 3 ч не влияла на уровень мРНК VE-кадгерина (Рис. 4Д).
Влияние эдаравона, дексаметазона и L—NMMA на экспрессию белка эндотелиальных плотных контактов ZO—1. Не были обнаружены изменения экспрессии ZO-1 при применении TNF-α + IL-1β в течение 24 ч. Близко-периферическая экспрессия ZO-1 повышалась при предварительной обработке эдаравоном или дексаметазоном в течение 24 ч по сравнению с другими группами (Рис. 5А — 5Ґ).
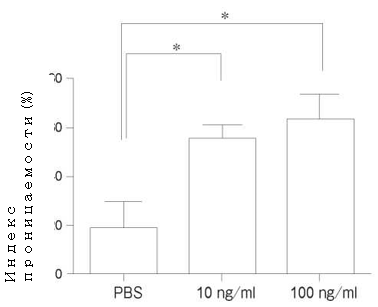
Рис. 1 Дозозависимый ответ изменения проницаемости эндотелиоцитов микроциркуляторного русла легких человека
У PMVEC человека на экспрессию ZO-1 мРНК (PMVEC) после стимуляции при помощи TNF-α + IL-1β в течение 24ч. Обе концентрации каждого из цитокинов — 10нг/мл и 100нг/мл — достоверно повышали проницаемость. Не наблюдалась достоверная разница между влиянием различных концентраций — 10 нг/мл и 100 нг/мл. Данные представлены в виде среднего значения ± SD (n = 4 в каждой группе). *p < 0,05, по сравнению с группой контроля. TNF-α, фактор некроза опухолей -α; IL-1β, интерлейкин-1β; PBS, натрий-фосфатный буфер.
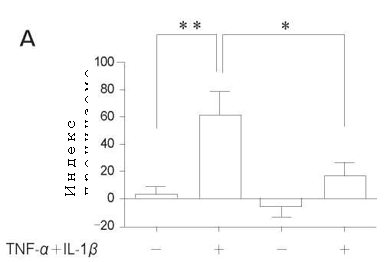
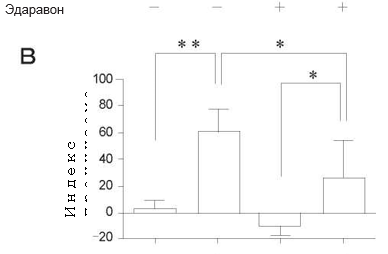
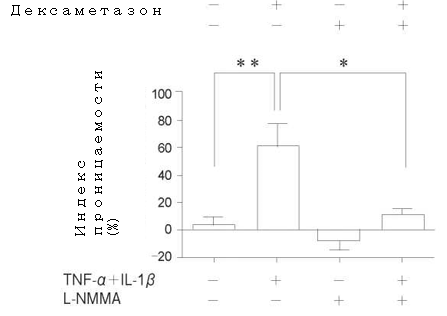
Рис. 2 Влияние предварительной обработки эдаравоном (A), дексаметазоном (Б) и N-монометил-L-аргинином (L-NMMA) (В) в течение 24ч на изменения проницаемости в популяции PMVEC человека после стимуляции при помощи TNF-α + IL-1β в течение 24 ч. Каждое из веществ достоверно подавляло повышенную проницаемость за счет влияния на TNF-α+ IL—1β. И хотя разница не была статистически значимой, каждое из веществ продемонстрировало тенденцию к способности снижать проницаемость по сравнению с контролем. Данные представлены в в виде среднего значения ± SD (n = 4 в каждой группе). * P <0,05, ** p <0,01.
Рис. 3 Влияние эдаравона, дексаметазона и N-монометил-L-аргинина (L-NMMA) на клеточную цитотоксичность в популяции PMVEC человека после стимуляции при помощи TNF-α+ IL-1 β. При определении клеточной цитотоксичности при помощи высвобождения ЛДГ не были обнаружены значительные отличия между группами.
Влияние TNF-α +IL-1β, эдаравона, дексаметазона и L—NMMA на образование sICAM—1, sVCAM—1, MCP—1 и IL—8 на PMVEC человека. Миграция лейкоцитов в ткани с воспалением приводит к повышенной проницаемости микроциркуляторного русла. Таким образом, изучалось влияние TNF-α IL-1β, эдаравона, дексаметазона и L-NMMAL-NMMA на образование sICAM-1, sVCAM-1, MCP-1, and IL-8 на PMVEC человека.
Влияние TNF-α + IL-1β на популяцию PMVEC человека в течение более 6 ч вызывало значительное повышение образования sICAM-1 и sVCAM-1 в супернатанте по сравнению с клетками, которые не были простимулированы. Уровни MCP-1 и IL-8 значительно росли после 3 ч и 6 ч соответственно при влиянии TNF-α + IL-1β (Рис. 6).
Мы исследовали ингибирующие эффекты предварительной обработки эдаравоном, дексаметазоном и L-NMMA в течение 24 ч на образование молекул адгезии и хемокинов. Наблюдалась тенденция к снижению образования sICAM-1 и sVCAM-1 под влиянием такой предварительной обработки, однако разница не была статистически значимой. Предварительная обработка дексаметазоном значительным образом подавляла образование MCP-1 и IL-8, вызванное TNF-α + IL-1β (Рис. 7).
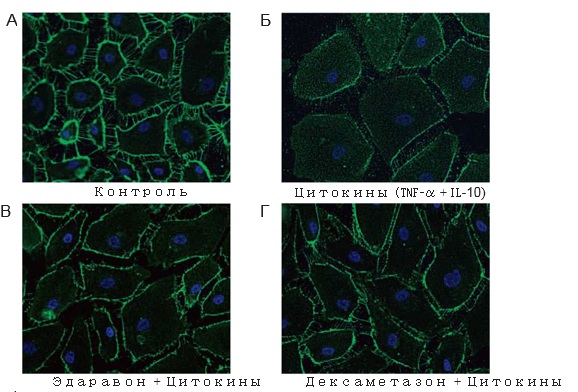
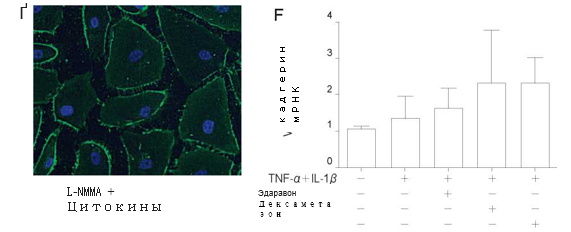
Рис. 4 Влияние TNF-α + IL 1 β, эдаравона, дексаметазона и N-монометил-L-аргинина (L-‘’NMMA) на экспрессию сосудисто-эндотелиального (VE)-кадгерина в популяции PMVEC человека. Для иммунофлюоресцентного исследования использовали обычные PMVEC человека на питательной среде (A), с добавлением TNF-α + IL-1β в течение 24 ч (Б), эдаравона (В), дексаметазона (Г), L-NMMA (Ґ) в течение 24 ч и применением TNF-α + IL-1βв течение 24 ч. TNF-α + IL-1 β снижали закрашивание VE-кадгерина. Предварительная обработка эдаравоном, дексаметазоном или L-NMMA, очевидно, подавляла этот эффект. Эти препараты существенно не влияли на мРНК VE-кадгерина (Д). Продемонстрированы репрезентативные исследования с использованием иммунофлюоресценции.
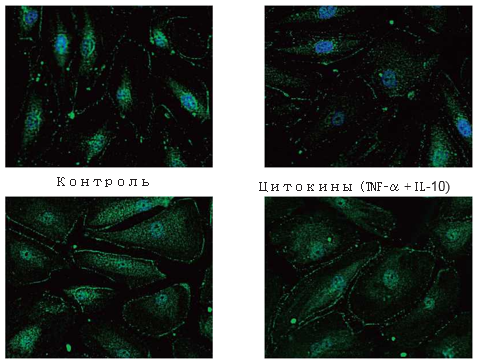
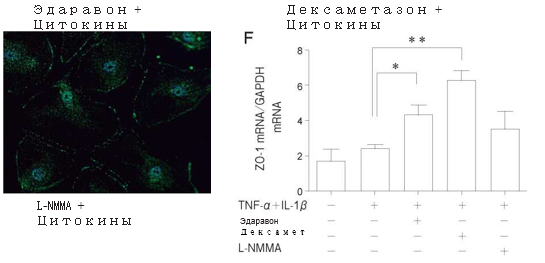
Рис. 5 Влияние TNF-α + IL-1β, эдаравона, дексаметазона и N-монометил-L-аргинина (L-NMMA) на экспрессию белка zonula occuldens-1 (ZO-1) в популяции PMVEC человека. Для иммунофлюоресцентного исследования использовали обычные PMVEC человека на питательной среде (A), с добавлением TNF-α + IL-1β в течение 24 ч (Б), эдаравона (В), дексаметазона (Г), L-NMMA (Ґ) в течение 24 ч и применением TNF-α + IL-1βв течение 24 ч. Не было обнаружены изменения экспрессии ZO-1 при применении TNF-α + IL-1β. Предварительная обработка эдаравоном или дексаметазоном повышала экспрессию ZO-1 по сравнению с группой контроля и группой, в которой применялись цитокины. Продемонстрированы репрезентативные исследования с использованием иммунофлюоресценции. При попередній обробці едаравоном або дексаметазоном спостерігалося посилення експресії ZO-1 мРНК (Д) в порівнянні з групою контролю та групою, в якій застосовували TNF-α + IL-1 β . Данные представлены в виде среднего значения ± SD (n = 4 в каждой группе). *p <0,05 по сравнению с группой TNF-α + IL-1A. **p < 0,01 по сравнению с группой TNF-α + IL-1A.
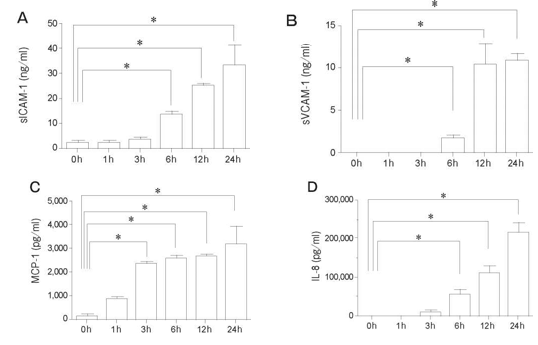
Рис. 6 Влияние TNF-α + IL-1β на секрецию sICAM-1, sVCAM-1, MCP-1 и IL-8 популяцией PMVEC человека. Обработка при помощи TNF-α + IL-1β (10 нг/ мл) в течение 6ч значительным образом повышала секрецию sICAM-1 (A), sVCAM-1 (Б) и IL-8 (Г). Секреция MCP-1 (C) повышалась при стимуляции в течение 3ч. Данные представлены в виде среднего значения ± SD (n = 4 в каждой группе). *p <0, 05 по сравнению с 0 ч в каждой группе. sICAM-1, растворимая молекула межклеточной адгезии-1; sVCAM-1, растворимая сосудисто-клеточная молекула адгезии -1; MCP-1, моноцитарный белок хемоатрактант-1; IL-8, Интерлейкин-8.
Обсуждение
ОРДС, состояние отека легких, обусловленное миграцией экссудата, богатого белками, в альвеолярное пространство, может быть вызван различными заболеваниями, включая вирусную пневмонию, сепсис и острый панкреатит. ОРДС также может возникать как результат эндотелиального и эпителиального повреждения [5]. В ответ на местные изменения биологических потребностей эндотелиоциты микроциркуляторного русла реагируют воспалением. Эти клетки играют важную роль в контроле обмена лейкоцитов и жидкостей между сосудами микроциркуляторного русла легких и альвеолами [23, 24].
В цитокиновом профиле аспирата из дыхательных путей детей, инфицированных вирусом гриппа A/H1N1pdm, обнаружены значительно повышенные концентрации TNF-α, IL-1β и других провоспалительных цитокинов на 5-й день с момента госпитализации, по сравнению с первым днем [25]. Существует сообщение о том, что вирусы гриппа A/H1N1pdm эффективно реплицируются в легких инфицированных мышей, хорьков и приматов. Эти вирусы могут вызывать тяжелые патологические нарушения в легких [4]. В результате при пневмонии, вызванной вирусом гриппа A/H1N1pdm, уровень провоспалительных цитокинов, продуцируемых местно в легких, повышен, и это способствует повышенной проницаемости сосудов микроциркуляторного русла легких.
Наши исследования показали, что стимуляция провоспалительными цитокинами (TNF-α + IL-1β, 10 нг/мл каждого) в течение 24 часов значительно повышала утечку декстрана из PMVEC человека. Предварительная обработка эдаравоном, дексаметазоном или L-NMMA в такой же степени достоверно подавляла повышение проницаемости эндотелиоцитов, вызванное этими цитокинами. Стимуляция провоспалительными цитокинами привела к нарушению уровня VE-кадгерина, важного компонента адгезивных
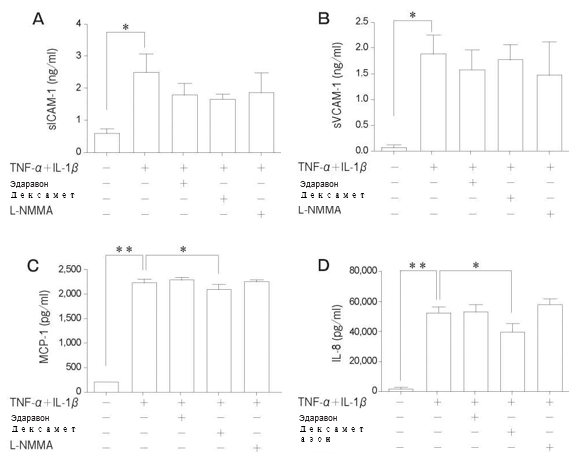
Рис. 7 Влияние эдаравона, дексаметазона и N-монометил-L-аргинина (L-NMMA) на секрецию sICAM-1, sVCAM-1, MCP-1 и IL-8 в популяции PMVEC человека после стимуляции при помощи TNF-α + IL-1β (10 нг/мл каждого). Не происходило подавления активацииsICAM-1 и sVCAM-1 под воздействием этих веществ. Значительное подавление MCP-1 и IL-8 наблюдалось при предварительной обработке дексаметазоном. Данные представлены в виде среднего значения± SD (n = 4 в каждой группе). *p < 0,05, **p < 0,01. sICAM-1, растворимая молекула межклеточной адгезии-1; sVCAM-1, растворимая сосудисто-клеточная молекула адгезии-1 ; MCP-1, моноцитарный белок хемоатрактант-1 контактов [8]. Тот факт, что предварительная обработка эдаравоном, дексаметазоном или L-NMMA подавляла нарушение уровня VE-кадгерина, обусловленного цитокинами, позволяет предположить, что эффектом, проявляемым этими препаратами, является задержка VE-кадгерина. Дифференциальные результаты были получены при условии определения уровня белков и мРНК-экспрессии VE-кадгерина; несмотря на то что не наблюдалось выраженное изменение экспрессии мРНК, стимуляция провоспалительными цитокинами привела к снижению уровня белка VE-кадгерина. Предварительная обработка эдаравоном, дексаметазоном или L-NMMA подавляла этот эффект. Данные отличия указывают скорее на косвенное влияние на экспрессию VE-кадгерина, нежели на прямую регуляцию транскрипции гена VE-кадгерина. Результаты также показали, что ZO- мРНК и близко-периферическая экспрессия повышались при предварительной обработке эдаравоном и дексаметазоном. Данные результаты свидетельствуют в пользу того, что эдаравон и дексаметазон могут укреплять плотные контакты за счет активации экспрессии ZO-1 [26, 27]. Предварительная обработка эдаравоном или дексаметазоном может играть роль в усилении плотных контактов, что приводит к снижению повышенной проницаемости PMVEC человека.
Некоторые предварительные исследования показали, что эдаравон повышает трансмонослойное электрическое сопротивление за счет стимуляции экспрессии белка адгезивных контактов [28]. Эдаравон предупреждает повышение проницаемости в условиях оксидативного стресса [29] в эндотелиоцитах пупковой вены человека. Дексаметазон повышает уровни белка VE-кадгерина и перестраивает цитоскелет [30] В данном исследовании представлены подобные результаты того, что эдаравон и дексаметазон предупреждают гиперпроницаемость PMVEC человека в услових цитокиновой стимуляции.
Наши эксперименты также показали, что стимуляция цитокинами повышала экспрессию мРНК и уровни белков ICAM-1, VCAM-1, MCP-1 и IL-8, подобно тому, как и в дермальных эндотелиоцитах микроциркуляторного русла человека[31, 32]. При предварительной обработке эдавароном или дексаметазоном наблюдалась тенденция к подавлению экспрессии ICAM-1 и VCAM-1, хотя эффект не был статистически значимым. Предварительная обработка дексаметазоном значительно снижала уровень MCP-1 и IL-8. Данные результаты дают основания думать о возможности того, что эдаравон и дексаметазон предупреждают усиление сосудистой проницаемости частично за счет подавления миграции лейкоцитов к месту воспаления в тканях.
В нашем недавнем сообщении говорилось о том, что введение TNF-α усиливает экспрессию белка MMP-9, растворяющего коллаген IV типа в эндотелиоцитах мозга мышей, что приводит к нарушению гематоэнцефалического барьера [33]. Однако введение TNF-α + IL-1β не привело ни к экспрессии мРНК, ни к секреции MMP-9 в PMVEC человека (данные не продемонстрированы). Это расхождение могло быть вызвано отличием между видами живых организмов, типами клеток, экспериментальными условиями или чувствительностью методов диагностики.
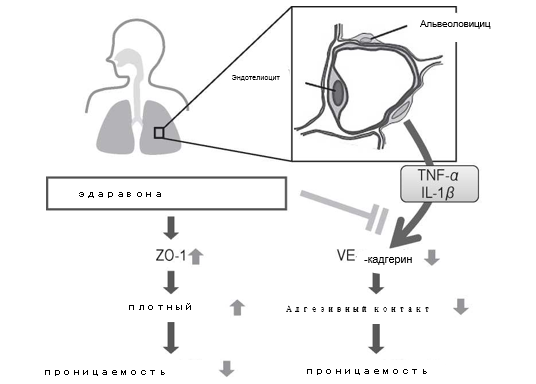
Рис. 8 Схематическая диаграмма, на которой изображена повышенная проницаемость легких, обусловленная TNF-a + IL-1 p и ингибирующее влияние эдаравона и дексаметазона.Таким образом, наши экспериментальные исследования показали, что эдаравон и дексаметазон могут предупредить развитие повышенной проницаемости в PMVEC человека, вызванной провоспалительными цитокинами, вероятно, в результате усиления адгезивных контактов и, не исключено, также за счет других механизмов (Рис. 8). Данные результаты могут внестиясность на клеточном и молекулярном уровне в стратегии лечения пациентов с ОРДС и пневмонией вследствие высокопатогенного гриппа птицы, приводящими к тяжелому поражению функции легких. Эдаравон и дексаметазон показали одинаковый эффект. Желательно добавить, что, учитывая то, что эдаравон обладает меньшим количеством побочных эффектов, чем дексаметазон [11], стоит ожидать, что эдаравон или комбинация эдаравона с дексаметазоном эффективны в лечении ОРДС в условиях клинической практики.
Список литературы
1. Rello J and Pop-Vicas A: Clinical review: primary influenza viral pneumonia. Crit Care (2009) 13 : 235.
2. Tran D, Vaudry W, Moore DL, Bettinger JA, Halperin SA, Schiefele DW and Aziz S; IMPACT investigators: Comparison of children hospitalized with seasonal versus pandemic influenza A, 2004-2009. Pediatrics (2012) 130 : 397-406.
3. Pabst D, Kuehn J, Schuler-Luettmann S, Wiebe K and Lebiedz P: Acute Respiratory Distress Syndrome as a presenting manifestation in young patients infected with H1N1 influenza virus. Eur J Intern Med (2011) 22 : e119-e124.
4. Itoh Y, Shinya K, Kiso M, Watanabe T, Sakoda Y, Hatta M, Muramoto Y, Tamura D, Sakai-Tagawa Y, Noda T, Sakabe S, Imai M, Hatta Y, Watanabe S, Li C, Yamada S, Fujii K, Murakami S, Imai H, Kakugawa S, Ito M, Takano R, Iwatsuki- Horimoto K, Shimojima M, Horimoto T, Goto H, Takahashi K, Makino A, Ishigaki H, Nakayama M, Okamatsu M, Warshauer D, Shult PA, Saito R, Suzuki H, Furuta Y, Yamashita M, Mitamura K, Nakano K, Nakamura M, Brockman-Schneider R, Mitamura H, Yamazaki M, Sugaya N, Suresh M, Ozawa M, Neumann G, Gern J, Kida H, Ogasawara K and Kawaoka Y: In vitro and in vivo characterization of new swine-origin H1N1 influenza viruses. Nature (2009) 460 : 1021-1025.
5. Ware LB and Matthay MA: The acute respiratory distress syndrome. N Engl J Med (2000) 342 : 1334-1349.
6. Fukuhra S, Sakurai A, Yamagishi A, Sako K and Mochizuki N: Vascular endothelial cadherin-mediated cell-cell adhesion regulated by a small GTPase, Rap1. J Biochem Mol Biol (2006) 39 : 132-139.
7. Dejana E, Corada M and Lampugnani MG: Endothelial cell-to-cell junctions. FASEB J (1995) 9 : 910-918.
8. Dejana E, Orsenigo F and Lampugnani MG: The role of adherens junctions and VE-cadherin in the control of vascular permeability. J Cell Sci (2008) 121 : 2115-2122.
9. Wittchen ES: Endothelial signaling in paracellular and transcellular leukocyte transmigration. Front Biosci (Landmark Ed) (2009) 14 : 2522-2545.
10. Ohta Y, Takamatsu K, Fukushima T, Ikegami S, Takeda I, Ota T, Goto K and Abe K: Efficacy of the free radical scavenger, edara- vone, for motor palsy of acute lacunar infarction. Intern Med (2009) 48 : 593-596.
11. Kikuchi K, Uchikado H, Miyagi N, Morimoto Y, Ito T, Tancharoen S, Miura N, Miyata K, Sakamoto R, Kikuchi C, Iida N, Shiomi N, Kuramoto T and Kawahara K: Beyond neurological disease: new targets for edaravone (Review). Int J Mol Med (2011) 28 : 899-906.
12. Tajima S, Bando M, Ishii Y, Hosono T, Yamasawa H, Ohno S, Takada T, Suzuki E, Gejyo F and Sugiyama Y: Effects of edara- vone, a free-radical scavenger, on bleomycin-induced lung injury in mice. Eur Respir J (2008) 32 : 1337-1343.
13. Tajima S, Soda M, Bando M, Enomoto M, Yamasawa H, Ohno S, Takada T, Suzuki E, Gejyo F and Sugiyama Y: Preventive effects of edaravone, a free radical scavenger, on lipopolysaccharide- induced lung injury in mice. Respirology (2008) 13 : 646-653.
14. Yang T, Mao YF, Liu SQ, Hou J, Cai ZY, Hu JY, Ni X, Deng XM and Zhu XY: Protective effects of the free radical scavenger edaravone on acute pancreatitis-associated lung injury. Eur J Pharmacol (2010) 630 : 152-157.
15. Yang T, Zhang J, Sun L, Zhu X, Li J, Wang J, Chen H, Bao R, Deng X, Hou J and Liu Y: Combined effects of a neutrophil elastase inhibitor (sivelestat sodium) and a free radical scavenger (edaravone) on lipopolysaccharide-induced acute lung injury in rats. Inflamm Res (2012) 61 : 563-569.
16. Sibbald WJ, Anderson RR, Reid B, Holliday RL and Driedger AA: Alveolo-capillary permeability in human septic ARDS. Effect of high-dose corticosteroid therapy. Chest (1981) 79 : 133-142.
17. Matsuo N: The role of intrapulmonary nitric oxide generation in the development of adult respiratory distress syndrome. Surg Today (1999) 29 : 1068-1074.
18. Maruo N, Morita I, Shirao M and Murota S: IL-6 increases endothelial permeability in vitro. Endocrinology (1992) 131 : 710714.
19. Zhu YT, Hayashida Y, Kheirkhah A, He H, Chen SY and Tseng SC: Characterization and comparison of intercellular adherent junctions expressed by human corneal endothelial cells in vivo and in vitro. Invest Ophthalmol Vis Sci (2008) 49 : 3879-3886.
20. Koch AE, Halloran MM, Haskell CJ, Shah MR and Polverini PJ: Angiogenesis mediated by soluble forms of E-selectin and vascular cell adhesion molecule-1. Nature (1995) 376 : 517-519.
21. Haubner F, Lehle K, Munzel D, Schmid C, Birnbaum DE and Preuner JG: Hyperglycemia increases the levels of vascular cellular adhesion molecule-1 and monocyte-chemoattractant-protein-1 in the diabetic endothelial cell. Biochem Biophys Res Commun (2007) 360 : 560-565.
22. Lehle K, Haubner F, Munzel D, Birnbaum DE and Preuner JG: Development of a disease-specific model to evaluate endothelial dysfunction in patients with diabetes mellitus. Biochem Biophys Res Commun (2007) 357 : 308-313.
23. Jiang MZ, Tsukahara H, Hayakawa K, Todoroki Y, Tamura S, Ohshima Y, Hiraoka M and Mayumi M: Effects of antioxidants and NO on TNF-alpha-induced adhesion molecule expression in human pulmonary microvascular endothelial cells. Respir Med (2005) 99 : 580-591.
24. Bogatcheva NV, Zemskova MA, Kovalenkov Y, Poirier C and Verin AD: Molecular mechanisms mediating protective effect of cAMP on lipopolysaccharide (LPS)-induced human lung microvas- cular endothelial cells (HLMVEC) hyperpermeability. J Cell Physiol (2009) 221 : 750-759.
25. Kawashima H, Go S, Kashiwagi Y, Morishima Y, Miura T, Ushio M, Nishimata S and Takekuma K: Cytokine profiles of suction pulmonary secretions from children infected with pandemic influenza A (H1N1) 2009. Crit Care (2010) 14 : 411.
26. Onodera H, Arito M, Sato T, Ito H, Hashimoto T, Tanaka Y, Kurokawa MS, Okamoto K, Suematsu N and Kato T: Novel effects of edaravone on human brain microvascular endothelial cells revealed by a proteomic approach. Brain Res (2013) 1534 : 87-94.
27. Lutgendorf MA, Ippolito DL, Mesngon MT, Tinnemore D, Dehart MJ, Dolinsky BM and Napolitano PG: Effect of dexamethasone administered with magnesium sulfate on inflammation-mediated degradation of the blood-brain barrier using an in vitro model. Reprod Sci (2014) 21 : 483-491.
28. Omori K, Shikata Y, Sarai K, Watanabe N, Wada J, Goda N, Kataoka N, Shikata K and Makino H: Edaravone mimics sphin- gosine-1-phosphate-induced endothelial barrier enhancement in human microvascular endothelial cells. Am J Physiol Cell Physiol (2007) 293 : C1523-C1531.
29. Morozumi J, Mishima S, Ohta S, Fujikawa T, Sasaki H, Noda M and Yukioka T: The role of edaravone on the impairment of endothelial barrier function induced by acute oxidative stress in cultured human umbilical vein endothelial cell monolayer. J Trauma (2005) 59 : 570-574; discussion 574.
30. Blecharz KG, Drenckhahn D and Forster CY: Glucocorticoids increase VE-cadherin expression and cause cytoskeletal rearrangements in murine brain endothelial cEND cells. J Cereb Blood Flow Metab (2008) 28 : 1139-1149.
31. Jiang MZ, Tsukahara H, Ohshima Y, Sato S, Todoroki Y, Hiraoka M and Mayumi M: Effects of antioxidant and nitric oxide on chemokine production in TNF-alpha-stimulated human dermal microvascular endothelial cells. Free Radic Res (2004) 38 : 473480.32.
32. Jiang MZ, Tsukahara H, Ohshima Y, Todoroki Y, Hiraoka M, Maeda M and Mayumi M: Effects of antioxidants and nitric oxide on TNF-alpha-induced adhesion molecule expression and NF-kappaB activation in human dermal microvascular endothelial cells. Life Sci (2004) 75 : 1159-1170.
33. Tsuge M, Yasui K, Ichiyawa T, Saito Y, Nagaoka Y, Yashiro M, Yamashita N and Morishima T: Increase of tumor necrosis factoralpha in the blood induces early activation of matrix metalloprotei- nase-9 in the brain. Microbiol Immunol (2010) 54 : 417-424.
Все авторы: Юкие Сайтоa, Йоусуке Фудзииa, Масато Яшироa, Мицуру Цуґеa, Нобуюки Носакаa, Нобуко Ямашитаб, Муцуко Ямадаa, Хироказу Цукахараa, Цунэо Моришимаa.
Кафедры педиатрии и вирологии, Высшая школа медицины университета Окаяма, Стоматология и фармацевтические науки, Окаяма 700-8558, Япония.