Підвищена легенева проникність відіграє роль у розвитку гострого респіраторного дистрес-синдрому (ГРДС), проте на сьогоднішній день немає доведених терапевтичних стратегій з контролю проникності мікроциркуляторного русла. Ми дослідили ефекти едаравону, дексаметазону та N-монометил-L-аргініну (L-NMMA) на зміни проникності ендотеліоцитів мікроциркуляторного русла легень людини (PMVEC – pulmonary microvascular endothelial cells) при гіперцитокінемії. Людські PMVEC були засіяні в камеру Бойдена. Після досягнення моношару внаслідок злиття живильні середовища були замінені відповідно на едаравон-, дексаметазон- та L-NMMA-вмісні культуральні середовища. Після 24-годинної інкубації моношар простимулювали фактором некрозу пухлин-α (TNF-α) та інтерлейкіном-1β (IL-1β). Було додано мічений флуоресцеїном декстран. Після цього було виміряно витік транслюдських PMVEC. Експресію судинно-ендотеліального кадгерину (VE-кадгерину) та білка zonula occludens-1 (ZO-1) визначали за допомогою кількісної полімеразно-ланцюгової реакції в режимі реального часу та імунофлюоресцентної мікроскопії. Результати показали, що TNF-α + IL-1β помітно підвищували проникність мікроциркуляторного русла легень. При попередній обробці едаравоном, дексаметазоном або L-NMMA спостерігалося зниження підвищеної проникності та пригнічення зниження експресії VE-кадгерину при імунофлюоресцентному зафарбовуванні. Едаравон і дексаметазон посилювали експресію ZO-1 і на рівні мРНК, і на білковому рівні. Едаравон і дексаметазон сповільнювали зміни проникності людських PMVEC, принаймні, частково внаслідок стимуляції VE-кадгерину. Загалом, отримані результати вказують на можливість застосування такого терапевтичного підходу в пацієнтів з ГРДС.
Інфекція, спричинена вірусом грипу, може призвести до розвитку тяжкої пневмонії, особливо в дітей та дорослих із супутніми захворюваннями [1, 2]. Багатьом пацієнтам необхідна вентиляційна підтримка внаслідок тяжких ускладнень, як-от гострий респіраторний дистрес-синдром (ГРДС) [3]. Є повідомлення про те, що пандемічні штами вірусу грипу A/H1N1 володіють афінністю до альвеолоцитів ІІ типу та безпосередньо проникають в легені [4]. Хоч і вважається, що підвищена проникність легень відіграє роль у
розвитку ГРДС [5], на сьогоднішній день не існує доступних медичних препаратів з клінічно доведеною ефективністю для контролю судинної проникності.
Судинно-ендотеліальні міжклітинні контакти, які контролюють судинну проникність, в основному утворені адгезивними та щільними контактами [6, 7]. Адгезивні контакти утворені представниками білків сім’ї кадгеринів. Судинно-ендотеліальний кадгерин (VE-кадгерин) регулюється системою позитивного та негативного контролю за допомогою різноманітних сигналів. Він динамічно регулює адгезію ендотеліоцитів та бар’єрну функцію кровоносних судин [6, 8]. Щільні контакти складаються з трансмембранних молекул, як-от: оклю-дин, клаудин та молекул адгезії міжклітинних контактів. Білок zonula occludens-1 (ZO-1), протеїн, який вкриває щільні контакти, об’єднує трансмембранні молекули з актиновим цитоскелетом.
У відповідь на прозапальні цитокіни в судинному ендотелії відбувається експресія клітинних молекул адгезії, включаючи молекулу міжклітинної адгезії-1 (ICAM-1) і судинно-клітинну молекулу адгезії-1 (VCAM-1), та секреція хемокінів, як-от: моноцитарного білка хемоатрактанту-1 (MCP-1) та інтерлейкіну-8 (IL-8) з метою активації міграції лейкоцитів до тканин із запаленням [9].
Згідно з наявними даними едаравон (3-метил-1-феніл-2-піразолін-5-он), який застосовують у лікуванні інфарктів головного мозку в ролі акцептора вільних радикалів [10], захищає, в тому числі, інші органи [11]. Декілька досліджень за участю тварин продемонстрували, що едаравон попереджує ураження легень, спричинене різними факторами, включаючи протипухлинні препарати, ліпополісахариди, та гострий панкреатит за рахунок своїх антиоксидантних та проти-запальних властивостей[12-15]. Попри це, існує дуже мало даних про те, чи едаравон чинить захисний вплив щодо розвитку ГРДС при підвищеній судинній проникності.
Під час пандемії інфекції грипу А в 2009 році частота тяжких пневмоній та ГРДС внаслідок підвищеної проникності легень значно перевищила частоту таких ускладнень, спричинених інфекцією вірусом сезонного грипу [2, 3]. Хоча спершу ми намагалися провести експериментальне дослідження інфекції грипу, використовуючи ендотеліоцити мікроциркуляторного русла легень людини (PMVEC), проте ані пандемічний вірус грипу A/H1N1, ані вірус A/H3N3Aichi не продемонстрували здатності інфіковувати ендотеліоцити або змінювати характеристики проникності (неопубліковані дані).
Тому ми прицільно дослідили зміни проникності ендотеліоцитів під впливом прозапальних цитокінів, які продукуються під час тяжких інфекційних захворювань, включаючи грип. Для цього дослідження ми використали моношарову модель PMVEC людини з метою визначення змін бар’єру проникності, які виникають в ендотеліоцитах при гіперцитокінемії. Існують повідомлення про те, що дексаметазон та інгібітор синтази оксиду азоту (NOS) знижують підвищену проникність легеневих судин при ГРДС [16, 17]. Таким чином, ми дослідили терапевтичний ефект едаравону на зміни проникності та, за тих самих експериментальних умов, порівняли ефекти едаравону з тими самими ефектами дексаметазону та інгібітора NOS.
Культура клітин. PMVEC людини були придбані у Lonza Group, Ltd. (Вокерсвілл, Меріленд, США (Walkersville, MD, USA) та зберігалися в BulletKit (EGM-2MV; Lonza), як рекомендовано виробником. Клітини культивували при концентрації повітря 95%, СО2 5% і температурі 37°C. Всі досліди були виконані на клітинах від 3-ого до 6-ого пасажів.Аналіз проникності. Для визначення проникності використовувалася камера Бойдена. Людські PMVEC були засіяні на мембранні вставки Transwell (пори 3,0 мкм; Becton, Dickinson and Co., Франклін Лейкс, Нью-Джерсі, США (Franklin Lakes, NJ, USA) з концентрацією 5 X 104 клітин/лунку. Клітини культивували протягом 3 днів. Після досягнення моношару внаслідок злиття живильні середовища у верхній камері (150 мкл) та нижній камері (750 мкл) були замінені відповідно на культуральні середовища, що містили едаравон (100мкМ; Mitsubishi Tanabe Pharma Corp., Токіо, Японія), дексаметазон (100мкM; Calbiochem Novabiochem Corp., Ла-Хойя, Каліфорнія, США (La Jolla, CA, USA), та N-монометил-L-аргінін (L-NMMA, 1мM; Calbiochem Novabiochem Corp.). Після 24-годинної інкубації живильне середовище було замінене на середовище, в якому містилися кожна з речовин та цитокіни. Фактор некрозу пухлин-α (TNF-α) (Peprotech Inc., Рокі Хілл, Нью-Джерсі, США (Rocky Hill, NJ, USA) та інтерлейкін-1β (IL-1β) (Peprotech Inc.) були використані у ролі про-запальних цитокінів. Під час ряду попередніх експериментів PMVEC людини були оброблені виключно TNF-α (100нг/мл) або IL-1β (100нг/мл) або їхньою комбінацією. Використані по одному, кожен з цитокінів – TNF-α та IL-1β – показали здатність підвищувати ендотеліальну проникність, проте зміни пермеабільності були незначними. Тільки комбінація TNF-α + IL-1β достовірно підвищувала проникність (дані не продемонстровані). Таким чином, в наступних експериментах PMVEC людини оброблялися TNF-α + IL- 1β при кожній з 2 концентрацій: (10нг/мл або 100нг/мл) протягом 24 год.
Як контрольний буфер використовувався натрій-фосфатний буфер. Для визначення витоку декстрану через транслюдські PMVEС було додано по 150 мкл середовища для кількісного визначення з декстраном, міченим флюоресцеїн-ізотіоціанатом (FITC-Dx; MW 3000) (100#г/мл) в кожну камеру; також до кожної з нижніх камер було додано по 750 мкл середовища для кількісного визначення. Після інкубації протягом 2 годин при температурі 37°C було виміряно інтенсивність флюоресценції середовища в нижніх камерах при довжині 485-538нм. Дані були виражені таким чином: індекс проникності (%) = [(кліренс, отриманий в експерименті) — (спонтанний кліренс)] X 100/[(кліренс самого фільтра) — (спонтанний кліренс)] [18]. Експерименти були проведені тричі та щоразу складалися з 4 паралельних дослідів.
Аналіз вивільнення лактатдегідрогенази (ЛДГ). Ушкодження клітин визначали за допомогою аналізу вивільнення ЛДГ (LDH Cytotoxicity Detection Kit; Takara Bio Inc., Шіґа, Японія (Shiga, Japan). Відсоток цитотоксичності обчислювали таким чином: цитотоксичність (%) = [вивільнення ЛДГ в експерименті (OD492) — спонтанне вивільнення ЛДГ (OD492)] X 100/[максимальний рівень вивільнення ЛДГ(OD492)] — [спонтанне вивільнення ЛДГ (OD492)]. Результати оптичної густини OD492 спонтанного вивільнення ЛДГ та OD492 максимального вивільнення ЛДГ були отримані відповідно з супернатанту культури клітин групи контролю та супернатанту клітин, оброблених 2% Triton X-100. Експерименти були проведені двічі та щоразу складалися з 4 паралельних дослідів.
Імунофлюоресцентна мікроскопія. Для експериментів із використанням імунофлюоресцентних методів було вирощено ендотеліоцити на слайд-камерах, вкритих колагеном-І (Becton, Dickinson and Co.). Надалі вони оброблялися едаравоном, дексаметазоном або L-NMMA впродовж 24 годин, а в подальшому – TNF-α + IL-1β (10мкг/мл) ще протягом 24 год. Після цього клітини були промиті натрій-фосфатним буфером та закріплені в 2% розчині альдегіду. Після пермеабілізації 0,1%Triton X-100 та блокування клітин провели їхню інкубацію з анти-VE- антитілом (10мкг/мл; R & D Systems, Міннеаполіс, Mіннесота, США (Minneapolis, MN, USA) та анти-ZO-1 антитілом (5мкг/мл; Genetex Inc., Ірвін, Каліфорнія, США (Irvine, CA, USA) протягом 60 хв. Як вторинне антитіло було використане Alexa Fluor 488-кон’юговане антитіло (Invitrogen Corp., Карлсбад, Каліфорнія, США (Carlsbad, CA, USA). Ядро зафарбовували 4’, 6-диамід- іно-2-феніліндолом (DAPI) у закріплюючому середовищі (Vectashield; Vector Laboratories Inc., Берлінгейм, Каліфорнія, США (Burlingame, CA, USA). Досліджувані зразки оцінювали зі допомогою флюоресцентного мікроскопа (BZ-9000 generation II; Keyence Co., Осака, Японія). Експерименти були проведені повторно 4 рази.
Кількісна полімеразна ланцюгова реакція в режимі реального часу (ПЛРврежимі реального часу). Для вивчення впливу цитокінів та препаратів на мРНК експресію VE-кадгерину та ZO-1 в популяції PMVEC в умовах експерименту застосовувалася ПЛР в режимі реального часу із повним вилученням РНК із клітин за допомогою специфічних праймерів, наведених у таблиці 1 [19]. Після досягнення злиття в 24-лункових планшетах було проведено інкубацію клітин протягом 24 годин з додаванням едаравону, дексаметазону або L-NMMA із подальшою обробкою TNF-α + IL-1β. Після стимуляції проведено вилучення комплементарної ДНК з використанням FastLane® Cell cDNA (Qiagen Inc., Хільден, Німеччина (Hilden, Germany). ПЛР в режимі реального часу проводилася за допомогою системи ПЛР в режимі реального часу (7500 Fast; Applied Biosystems, Фостер Сіті, Каліфорнія, США (Foster City, CA, USA) з SYBR ®Premix Ex Taq (Takara Bio Inc.). Суміш для ПЛР, сумарним об’ємом 50 мкл, складалася з реагента 1 X SYBR ®Premix Ex Taq, який містив ДНК-полімеразу, барвник SYBR Green, dNTP-суміш та ПЛР-буфер, по 0,2 мкМ прямого та зворотнього праймерів, а також досліджуваних зразків кДНК. Гліцеральдегід-3-фосфатдегідрогеназа (GAPDH)

була використана з метою нормалізації синтезу кДНК. Результати отримані в ході 2 різних експериментальних умов та проведення 4 паралельних дослідів у кожній із них.
Ферментний імуносорбентний аналіз (ELISA). Визначення рівня експресії молекул адгезії в супернатанті культури клітин відбувалося in vitro за моделлю Леле [20-22]. Рівні розчинних ICAM-1 (sICAM-1) та розчинних VCAM-1 (sVCAM-1) вимірювалися (аналізатор Luminex 100/200 System; Luminex Corp., Остін, Техас, США (Austin, TX, USA) за допомогою діагностичної панелі Human CVD Panel 1 96-well Plate Assay (Millipore Corp., Бедфорд, Mассачусетс, США (Bedford, MA, USA). Визначення рівнів MCP-1 and IL-8 також проводили за допомогою ELISA (R & D Systems). Результати отримані в ході 2 різних експериментальних умов з 4 паралельними дослідами в кожній із них.
Статистичний аналіз. Усі величини подані у вигляді середнього значення ± SD. Відмінності між групами були проаналізовані на предмет статистичної достовірності за допомогою одно-стороннього дисперсійного аналізу та критерію множинного порівняння Тьюкі. Достовірними вважали відмінності при значеннях р<0,05.
Результати
Зміна проникності моношару PMVEC людини. Як зображено на рис. 1, ендотеліальна проникність значно зростала при впливі TNF-α + IL-1β при концентраціях 10нг/мл та 100нг/мл у порівнянні з контрольною групою. Не спостерігалося достовірної різниці між впливом різних концентрацій – 10нг/мл та 100нг/мл. Для наступних експериментів було прийнято робочу концентрацію 10нг/мл. При попередній обробці едаравоном (100#M) спостерігалося значне зниження підвищеної проникності на 45% у порівнянні з групою, в якій застосовували тільки TNF-α + IL-1β (Рис. 2A). При попередній обробці дексаметазоном (100#M) спостерігалося значне зниження підвищеної проникності на 35% у порівнянні з групою, в якій застосовували тільки TNF-α + IL-1β (Рис. 2Б). При попередній обробці L-NMMA (1мM) спостерігалося значне зниження підвищеної проникності на 50% у порівнянні з групою, в якій застосовували тільки TNF-α + IL-1β (Рис. 2В).
Клітинна цитотоксичність. Ушкодження клітин оцінювали за допомогою визначення вивільнення ЛДГ. На вивільнення ЛДГ суттєво не впливало попередня обробка культури ендотеліоцитів едаравоном, дексаметазоном або L-NMMA у порівнянні з групою, в якій застосовували тільки TNF-α + IL-1β (Рис. 3). Це вказує на те, що зниження підвищеної проникності в цьому дослідженні при попередній обробці згаданими речовинами не було спричинене гальмуванням ушкодження клітинної мембрани або загибеллю клітини.
Вплив едаравону, дексаметазону та L–NMMA на експресію білка ендотеліальних адгезивних контактів VE–кадгерину. Вивчався вплив едаравону, дексаметазону та L-NMMA на експресію VE-кадгерину з метою визначення взаємозв’язків між змінами проникності та клітинно-клітинною адгезією. Імунофлюоресцентне фарбування показало, що зафарбовування VE-кадгерину зменшувалося після стимуляції TNF-α + IL-1β . Попередня обробка едаравоном, дексаметазоном або L-NMMA протягом 24 год. ослаблювала стимулюючий вплив TNF-α + IL-1β (Рис. 4А-4Ґ). Попередня обробка едаравоном, дексаметазоном або L-NMMA протягом 24 год. з наступним застосуванням TNF-α + IL-1β впродовж 3 год. не впливала на рівень мРНК VE-кадгерину (Рис. 4Д).
Вплив едаравону, дексаметазону та L–NMMA на експресію білка ендотеліальних щільних контактів ZO–1. Не було виявлено змін експресії ZO-1 при застосуванні TNF-α + IL-1β протягом 24 год. Близько-периферична експресія ZO-1 підвищувалася при попередній обробці едаравоном або дексаметазоном впродовж 24 год. у порівнянні з іншими групами (Рис. 5А-5Ґ). У PMVEC людини на експресію ZO-1 мРНК не впливала стимуляція за допомогою TNF-α + IL-1β, проте
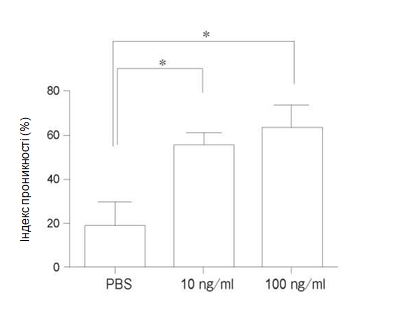
Рис. 1 Дозозалежна відповідь зміни проникності ендотеліоцитів мікроциркуляторного русла легень людини (PMVEC) після стимуляції за допомогою TNF-α + IL-1β впродовж24год. Обидві концентрації кожного з цитокінів – 10нг/мл та 100нг/мл – достовірно підвищували проникність. Не спостерігалося достовірної різниці між впливом різних концентрацій – 10нг/мл та 100нг/мл. Дані представлені у вигляді середнього значення ± SD (n = 4 в кожній групі). *p < 0,05 порівняно з групою контролю. TNF-α, фактор нек- розу пухлин-α; IL-1β, інтерлейкін-1β; PBS, натрій-фосфатний буфер.
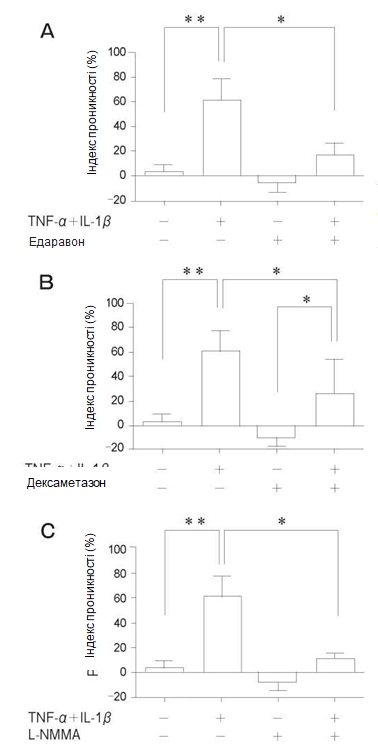
Рис. 2 Вплив попередньої обробки едаравоном (A), дексаметазоном (Б) та N-монометил-L-аргініном (L-NMMA) (В) протягом 24год. на зміни проникності у популяції PMVEC людини після стимуляції за допомогою TNF-α + IL-1β впродовж24 год. Кожна з речовин достовірно пригнічувала підвищену проникність за рахунок впливу на TNF-α+ IL–1β. І хоча різниця не була статистично значущою, кожна з речовин продемонструвала тенденцію до здатності знижувати проникність у порівнянні з контролем. Дані представлені у вигляді середнього значення ± SD (n = 4 в кожній групі). *p < 0,05, **p < 0,01.
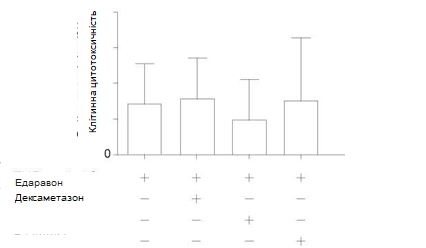
Рис. 3 Вплив едаравону, дексаметазону та N-монометил-L-аргініну (L-NMMA) на клітинну цитотоксичність у популяції PMVEC людини після стимуляції за допомогою TNF-α+ IL-1 β. При визначенні клітинної цитотоксичності за допомогою вивільнення ЛДГ не було виявлено значних відмінностей між групами.
експресія достовірно посилювалася при попередній обробці едаравоном або дексаметазоном (Рис. 5Д).
Вплив TNF-α + IL-1β, едаравону, дексаметазону та L–NMMA на утворення sICAM–1, sVCAM–1, MCP–1 та IL–8 на PMVEC людини. Міграція лейкоцитів до тканин із запаленням призводить до підвищеної проникності мікроциркуляторного русла. Таким чином, вивчався вплив TNF-α IL-1β, едаравону, дексаметазону та L-NMMAL-NMMA на утворення sICAM-1, sVCAM-1, MCP-1, and IL-8 на PMVEC людини.
Вплив TNF-α + IL-1β на популяцію PMVEC людини впродовж довше, ніж 6 год. спричинювало значне підвищення утворення sICAM-1 та sVCAM-1 в супернатанті порівняно з клітинами, які не були простимульовані. Рівні MCP-1 та IL-8 значно зростали після 3 год. та 6 год. відповідно при впливі TNF-α + IL-1β (Рис. 6). Ми дослідили інгібуючі ефекти попередньої обробки едаравоном, дексаметазоном та L-NMMA впродовж 24 год. на утворення молекул адгезії та хемокінів. Спостерігалася тенденція до зниження утворення sICAM-1 та sVCAM-1 під впливом такої попередньої обробки, проте різниця не була статистично значущою. Попередня обробка дексаметазоном значним чином пригнічувала утворення MCP-1 та IL-8, спричинене TNF-α + IL-1β (Рис. 7).
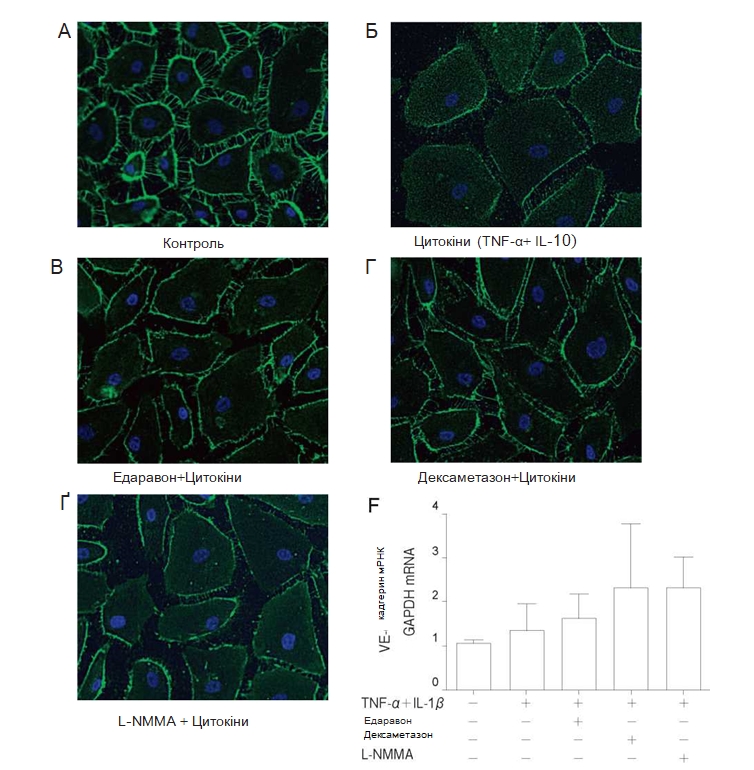
Рис. 3 Вплив едаравону, дексаметазону та N-монометил-L-аргініну (L-NMMA) на клітинну цитотоксичність у популяції PMVEC людини після стимуляції за допомогою TNF-α+ IL-1 β. При визначенні клітинної цитотоксичності за допомогою вивільнення ЛДГ не було виявлено значних відмінностей між групами.
експресія достовірно посилювалася при попередній обробці едаравоном або дексаметазоном (Рис. 5Д).
Вплив TNF-α + IL-1β, едаравону, дексаметазону та L–NMMA на утворення sICAM–1, sVCAM–1, MCP–1 та IL–8 на PMVEC людини. Міграція лейкоцитів до тканин із запаленням призводить до підвищеної проникності мікроциркуляторного русла. Таким чином, вивчався вплив TNF-α IL-1β, едаравону, дексаметазону та L-NMMAL-NMMA на утворення sICAM-1, sVCAM-1, MCP-1, and IL-8 на PMVEC людини.
Вплив TNF-α + IL-1β на популяцію PMVEC людини впродовж довше, ніж 6 год. спричинювало значне підвищення утворення sICAM-1 та sVCAM-1 в супернатанті порівняно з клітинами, які не були простимульовані. Рівні MCP-1 та IL-8 значно зростали після 3 год. та 6 год. відповідно при впливі TNF-α + IL-1β (Рис. 6). Ми дослідили інгібуючі ефекти попередньої обробки едаравоном, дексаметазоном та L-NMMA впродовж 24 год. на утворення молекул адгезії та хемокінів. Спостерігалася тенденція до зниження утворення sICAM-1 та sVCAM-1 під впливом такої попередньої обробки, проте різниця не була статистично значущою. Попередня обробка дексаметазоном значним чином пригнічувала утворення MCP-1 та IL-8, спричинене TNF-α + IL-1β (Рис. 7).
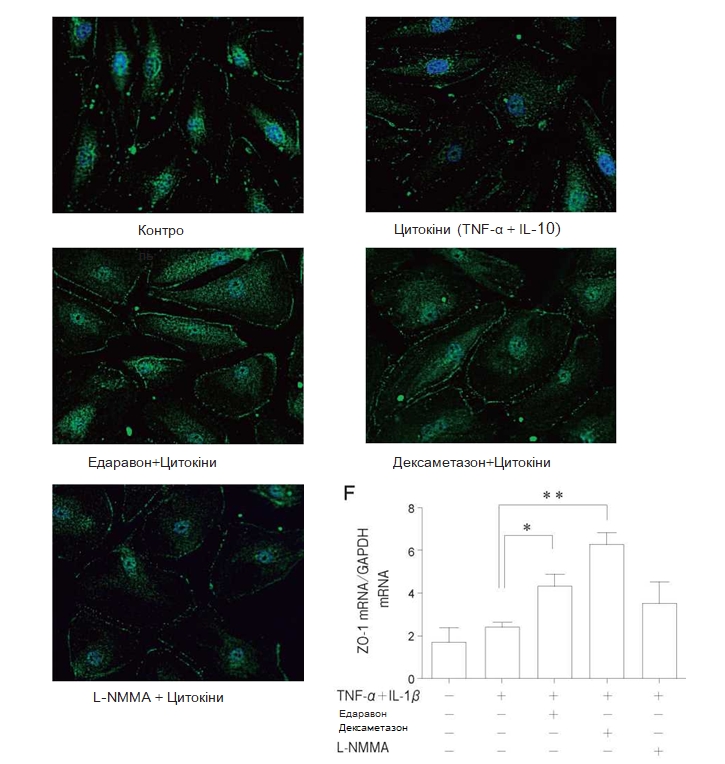
Рис. 5 Вплив TNF-α + IL-1β, едаравону, дексаметазону та N-монометил-L-аргініну (L-NMMA) на експресію білка zonula occuldens-1 (ZO-1) в популяції PMVEC людини. Для імунофлюоресцентного дослідження використовували звичайні PMVEC людини на живильному середовищі (A), з додаванням TNF-α + IL-1β впродовж24год (Б), едаравону (В), дексаметазону (Г), L-NMMA (Ґ) впродовж 24год. та застосуванням TNF-α + IL-1βпротягом24 год. Не було виявлено змін експресії ZO-1 при застосуванні TNF-α + IL-1β. Попередня обробка едара-воном або дексаметазоном підвищувала експресію ZO-1 в порівнянні з групою контролю та групою, в якій застосовувалися цитокіни. Продемонстровано репрезентативні дослідження з використанням імунофлюоресценції. При попередній обробці едаравоном або дексаметазоном спостерігалося посилення експресії ZO-1 мРНК (Д) в порівнянні з групою контролю та групою, в якій застосовували TNF-α + IL-1 β . Дані представлені у вигляді середнього значення± SD (n = 4 в кожній групі). *p < 0,05 у порівнянні з групою TNF-α + IL-1 A . **p < 0,01 у порівнянні з групою TNF-α + IL-1 A .
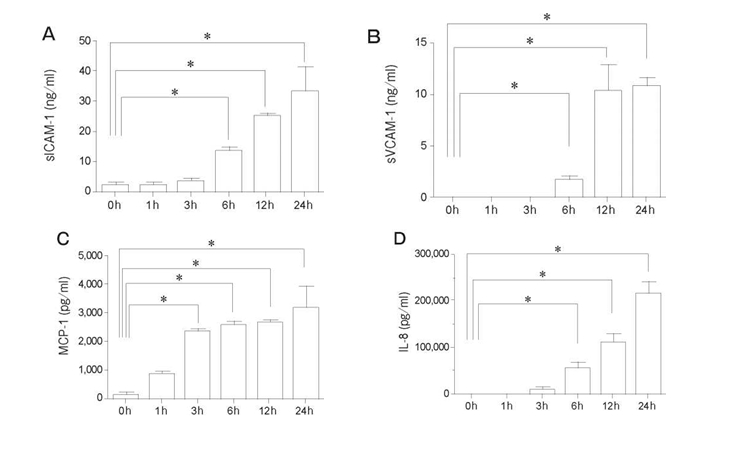
Рис. 6 Вплив TNF-α+ IL-1β на секрецію sICAM-1, sVCAM-1, MCP-1 та IL-8 популяцією PMVEC людини. Обробка за допомогою TNF- α + IL-1 β (10нг/мл) протягом 6год. значним чином підвищувало секрецію sICAM-1 (A), sVCAM-1 (Б) та IL-8 (Г). Секреція MCP-1 (C) підвищувалася при стимуляції впродовж 3год. Дані представлені у вигляді середнього значення ± SD (n = 4 в кожній групі). *p < 0,05 порівняно з 0год в кожній групі. sICAM-1, розчинна молекула міжклітинної адгезії-1; sVCAM-1, розчинна судинно-клітинна молекула адгезії -1; MCP-1, моноцитарний білок хемоатрактант-1 ; IL-8, Інтерлейкін-8.
ГРДС, стан набряку легень, зумовлений міграцією ексудату, багатого на білки, в альвеолярний простір, може бути спричинений різноманітними захворюваннями, включаючи вірусну пневмонію, сепсис та гострий панкреатит. ГРДС також може виникати як результат ендотеліального та епітеліального пошкодження[5]. У відповідь на місцеві зміни біологічних потреб ендотеліоцити мікроциркуляторного русла реагують запаленням. Ці клітини відіграють важливу роль у контролі обміну лейкоцитів та рідин між судинами мікроциркуляторного русла легень та альвеолами [23, 24].
У цитокіновому профілі аспірату з дихальних шляхів дітей, інфікованих вірусом грипу A/H1N1pdm, виявлено значно підвищені концентрації TNF-α, IL-1β та інших прозапальних цитокінів на 5-ий день з моменту госпіталізації в порівнянні з першим днем [25]. Є повідомлення про те, що віруси грипу A/H1N1pdm ефективно реплікуються в легенях інфікованих мишей, тхорів та приматів. Ці віруси можуть спричинювати тяжкі патологічні порушення у легенях [4]. Як наслідок, при пневмонії, зумовленій вірусом грипу A/H1N1pdm, рівень прозапальних цитокінів, які продукуються місцево у легенях, є підвищений, і це сприяє підвищеній проникності судин мікроциркуляторного русла легень. Наші дослідження показали, що стимуляція прозапальними цитокінами (TNF-α + IL-1β, 10нг/мл кожного) протягом 24 годин значно підвищувала витік декстрану з PMVEC людини. Попередня обробка едаравоном, дексаметазоном або L-NMMA такою самою мірою достовірно пригнічувала підвищення проникності ендотеліоцитів, спричинене цими цитокінами. Стимуляція прозапальними цитокінами призвела до порушення рівня VE-кадгерину, важливого компонента адгезивних контактів [8]. Той факт, що попередня обробка едаравоном, дексаметазоном або L-NMMA пригнічувала порушення рівня VE-кадгерину, зумовленого цитокінами, дозволяє припустити, що ефектом, який проявляють ці препарати, є затримка VE-кадгерину. Диференційні результати були отримані за умов визначення рівня білків та мРНК-експресії VE-кадгерину; незважаючи на те, що не спостерігалося вираженої зміни експресії мРНК, стимуляція прозапальними цитокінами призвела до зниження рівня білка VE-кадгерину. Попередня обробка едаравоном, дексаметазоном або L-NMMA пригнічувала цей ефект. Ці відмінності вказують скоріше на непрямий вплив на експресію VE-кадгерину, аніж на пряму регуляцію транскрипції гену VE-кадгерину. Результати також показали, що ZO- мРНК та близько-периферична експресія підвищувалися при попередній обробці едаравоном і дексаметазоном. Ці результати свідчать на користь того, що едаравон і дексаметазон можуть зміцнювати щільні контакти за рахунок активації експресії ZO-1 [26, 27]. Попередня обробка едаравоном або дексаметазоном може відігравати роль у посиленні щільних контактів, що призводить до зниження підвищеної проникності PMVEC людини .
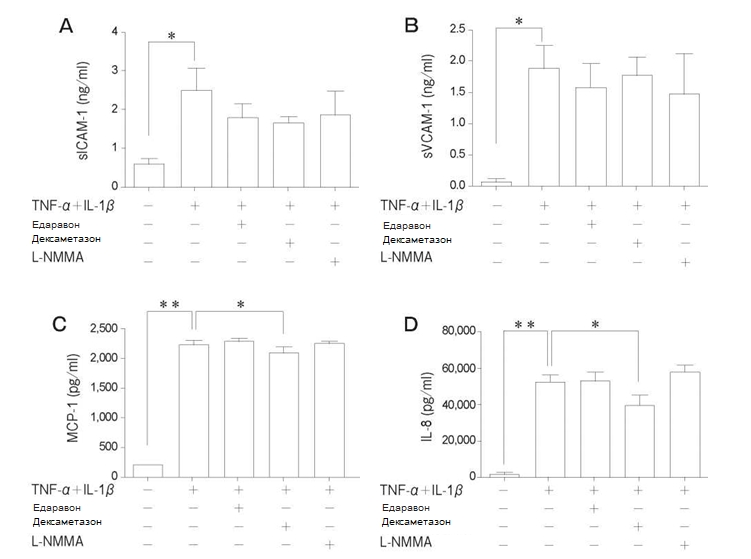
Рис. 7 Вплив едаравону, дексаметазону та N-монометил-L-аргініну (L-NMMA) на секрецію sICAM-1, sVCAM-1, MCP-1та IL-8 у популяції PMVEC людини після стимуляції за допомогою TNF-α + IL-1 β (10нг/мл кожного). Не відбувалося пригнічення активаціїsICAM-1 та sVCAM-1 під дією цих речовин. Значне пригнічення MCP-1 та IL-8 спостерігалося при попередній обробці дексаметазоном. Дані представлені у вигляді середнього значення± SD (n = 4 в кожній групі). *p < 0,05, **p < 0,01. sICAM-1, розчинна молекула міжклітинної адгезії-1; sVCAM-1, розчинна судинно-клітинна молекула адгезії-1 ; MCP-1, моноцитарний білок хемоатрактант-1 ; IL-8, інтерлейкін-8.
Деякі попередні дослідження показали, що едаравон підвищує трансмоношаровий електричний опір за рахунок стимуляції експресії білка адгезивних контактів [28]. Едаравон попереджує підвищення проникності в умовах оксидативного стресу [29] в ендотеліоцитах пупкової вени людини. Дексаметазон підвищує рівні білка VE-кадгерину та перебудовує цитоскелет [30] У цьому дослідженні представлені подібні результати про те, що едаравон і дексаметазон попереджують гіперпроникність PMVEC людини в умовах цитокінової стимуляції.
Наші експерименти також показали, що стимуляція цитокінами підвищувала експресію мРНК та рівні білків ICAM-1, VCAM-1, MCP-1 та IL-8, подібно як і в дермальних ендотеліоцитах мікроциркуляторного русла людини [31, 32]. При попередній обробці едавароном або дексаметазоном спостерігалася тенденція до пригнічення експресії ICAM-1 та VCAM-1, хоча ефект не був статистично значущим. Попередня обробка дексаметазоном значно знижувала рівень MCP-1 та IL-8. Ці результати дають підстави думати про можливість того, що едаравон і дексаметазон попереджують посилення судинної проникності частково за рахунок пригнічення міграції лейкоцитів до місця запалення в тканинах. У нашому нещодавньому повідомленні йшлося про те, що введення TNF-α посилює експресію білка MMP-9, який розчиняє колаген IV типу в ендотеліоцитах мозку мишей, що призводить до порушення гематоенцефалічного бар’єру [33]. Однак введення TNF-α + IL-1β не призвело ані до експресії мРНК, ані до секреції MMP-9 у PMVEC людини (дані не продемонстровані). Ця розбіжність могла бути спричинена відмінністю між видами живих організмів, типами клітин, експериментальними умовами або чутливістю методів діагностики.
Отож, наші експериментальні дослідження показали, що едаравон і дексаметазон можуть попередити розвиток підвищеної проникності у PMVEC людини, спричинену прозапальними цитокі нами, вірогідно, внаслідок посилення адгезивних контактів та, не виключено, також за рахунок інших меха¬нізмів (Рис. 8). Ці результати можуть внести ясність на клітинному та молекулярному рівні в стратегії лікування пацієнтів з ГРДС та пневмонією внаслідок високопатогенного грипу птиці, які призводять до тяжкого ураження функції легень. Едаравон і дексаметазон показали однаковий ефект. Варто додати, що враховуючи те, що едаравон володіє меншою кількістю побічних ефектів, ніж дексаметазон [11], варто очікувати, що едаравон або комбінація едаравону з дексаметазоном є ефективними в лікуванні ГРДС в умовах клінічної практики.
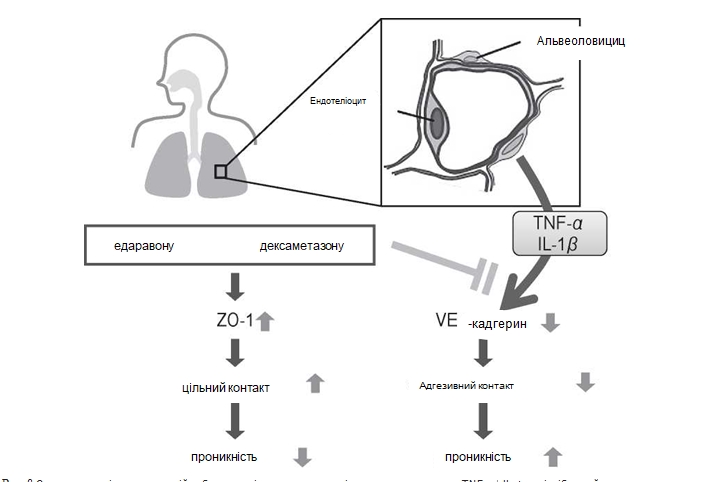
Рис. 8 Схематична діаграма, на якій зображено підвищену проникність легень, зумовлену TNF-a + IL-1 p та інгібуючий вплив едаравону та дексаметазону.
Список літератури
- Rello J and Pop-Vicas A: Clinical review: primary influenza viral pneumonia. Crit Care (2009) 13 : 235.
- Tran D, Vaudry W, Moore DL, Bettinger JA, Halperin SA, Schiefele DW and Aziz S; IMPACT investigators: Comparison of children hospitalized with seasonal versus pandemic influenza A, 2004-2009. Pediatrics (2012) 130 : 397-406.
- Pabst D, Kuehn J, Schuler-Luettmann S, Wiebe K and Lebiedz P: Acute Respiratory Distress Syndrome as a presenting manifestation in young patients infected with H1N1 influenza virus. Eur J Intern Med (2011) 22 : e119-e124.
- Itoh Y, Shinya K, Kiso M, Watanabe T, Sakoda Y, Hatta M, Muramoto Y, Tamura D, Sakai-Tagawa Y, Noda T, Sakabe S, Imai M, Hatta Y, Watanabe S, Li C, Yamada S, Fujii K, Murakami S, Imai H, Kakugawa S, Ito M, Takano R, Iwatsuki- Horimoto K, Shimojima M, Horimoto T, Goto H, Takahashi K, Makino A, Ishigaki H, Nakayama M, Okamatsu M, Warshauer D, Shult PA, Saito R, Suzuki H, Furuta Y, Yamashita M, Mitamura K, Nakano K, Nakamura M, Brockman-Schneider R, Mitamura H, Yamazaki M, Sugaya N, Suresh M, Ozawa M, Neumann G, Gern J, Kida H, Ogasawara K and Kawaoka Y: In vitro and in vivo characterization of new swine-origin H1N1 influenza viruses. Nature (2009) 460 : 1021-1025.
- Ware LB and Matthay MA: The acute respiratory distress syndrome. N Engl J Med (2000) 342 : 1334-1349.
- Fukuhra S, Sakurai A, Yamagishi A, Sako K and Mochizuki N: Vascular endothelial cadherin-mediated cell-cell adhesion regulated by a small GTPase, Rap1. J Biochem Mol Biol (2006) 39 : 132-139.
- Dejana E, Corada M and Lampugnani MG: Endothelial cell-to-cell junctions. FASEB J (1995) 9 : 910-918.
- Dejana E, Orsenigo F and Lampugnani MG: The role of adherens junctions and VE-cadherin in the control of vascular permeability. J Cell Sci (2008) 121 : 2115-2122.
- Wittchen ES: Endothelial signaling in paracellular and transcellular leukocyte transmigration. Front Biosci (Landmark Ed) (2009) 14 : 2522-2545.
- Ohta Y, Takamatsu K, Fukushima T, Ikegami S, Takeda I, Ota T, Goto K and Abe K: Efficacy of the free radical scavenger, edara- vone, for motor palsy of acute lacunar infarction. Intern Med (2009) 48 : 593-596.
- Kikuchi K, Uchikado H, Miyagi N, Morimoto Y, Ito T, Tancharoen S, Miura N, Miyata K, Sakamoto R, Kikuchi C, Iida N, Shiomi N, Kuramoto T and Kawahara K: Beyond neurological disease: new targets for edaravone (Review). Int J Mol Med (2011) 28 : 899-906.
- Tajima S, Bando M, Ishii Y, Hosono T, Yamasawa H, Ohno S, Takada T, Suzuki E, Gejyo F and Sugiyama Y: Effects of edara- vone, a free-radical scavenger, on bleomycin-induced lung injury in mice. Eur Respir J (2008) 32 : 1337-1343.
- Tajima S, Soda M, Bando M, Enomoto M, Yamasawa H, Ohno S, Takada T, Suzuki E, Gejyo F and Sugiyama Y: Preventive effects of edaravone, a free radical scavenger, on lipopolysaccharide- induced lung injury in mice. Respirology (2008) 13 : 646-653.
- Yang T, Mao YF, Liu SQ, Hou J, Cai ZY, Hu JY, Ni X, Deng XM and Zhu XY: Protective effects of the free radical scavenger edaravone on acute pancreatitis-associated lung injury. Eur J Pharmacol (2010) 630 : 152-157.
- Yang T, Zhang J, Sun L, Zhu X, Li J, Wang J, Chen H, Bao R, Deng X, Hou J and Liu Y: Combined effects of a neutrophil elastase inhibitor (sivelestat sodium) and a free radical scavenger (edaravone) on lipopolysaccharide-induced acute lung injury in rats. Inflamm Res (2012) 61 : 563-569.
- Sibbald WJ, Anderson RR, Reid B, Holliday RL and Driedger AA: Alveolo-capillary permeability in human septic ARDS. Effect of high-dose corticosteroid therapy. Chest (1981) 79 : 133-142.
- Matsuo N: The role of intrapulmonary nitric oxide generation in the development of adult respiratory distress syndrome. Surg Today (1999) 29 : 1068-1074.
- Maruo N, Morita I, Shirao M and Murota S: IL-6 increases endothelial permeability in vitro. Endocrinology (1992) 131 : 710714.
- Zhu YT, Hayashida Y, Kheirkhah A, He H, Chen SY and Tseng SC: Characterization and comparison of intercellular adherent junctions expressed by human corneal endothelial cells in vivo and in vitro. Invest Ophthalmol Vis Sci (2008) 49 : 3879-3886.
- Koch AE, Halloran MM, Haskell CJ, Shah MR and Polverini PJ: Angiogenesis mediated by soluble forms of E-selectin and vascular cell adhesion molecule-1. Nature (1995) 376 : 517-519.
- Haubner F, Lehle K, Munzel D, Schmid C, Birnbaum DE and Preuner JG: Hyperglycemia increases the levels of vascular cellular adhesion molecule-1 and monocyte-chemoattractant-protein-1 in the diabetic endothelial cell. Biochem Biophys Res Commun (2007) 360 : 560-565.
- Lehle K, Haubner F, Munzel D, Birnbaum DE and Preuner JG: Development of a disease-specific model to evaluate endothelial dysfunction in patients with diabetes mellitus. Biochem Biophys Res Commun (2007) 357 : 308-313.
- Jiang MZ, Tsukahara H, Hayakawa K, Todoroki Y, Tamura S, Ohshima Y, Hiraoka M and Mayumi M: Effects of antioxidants and NO on TNF-alpha-induced adhesion molecule expression in human pulmonary microvascular endothelial cells. Respir Med (2005) 99 : 580-591.
- Bogatcheva NV, Zemskova MA, Kovalenkov Y, Poirier C and Verin AD: Molecular mechanisms mediating protective effect of cAMP on lipopolysaccharide (LPS)-induced human lung microvas- cular endothelial cells (HLMVEC) hyperpermeability. J Cell Physiol (2009) 221 : 750-759.
- Kawashima H, Go S, Kashiwagi Y, Morishima Y, Miura T, Ushio M, Nishimata S and Takekuma K: Cytokine profiles of suction pulmonary secretions from children infected with pandemic influenza A (H1N1) 2009. Crit Care (2010) 14 : 411.
- Onodera H, Arito M, Sato T, Ito H, Hashimoto T, Tanaka Y, Kurokawa MS, Okamoto K, Suematsu N and Kato T: Novel effects of edaravone on human brain microvascular endothelial cells revealed by a proteomic approach. Brain Res (2013) 1534 : 87-94.
- Lutgendorf MA, Ippolito DL, Mesngon MT, Tinnemore D, Dehart MJ, Dolinsky BM and Napolitano PG: Effect of dexamethasone administered with magnesium sulfate on inflammation-mediated degradation of the blood-brain barrier using an in vitro model. Reprod Sci (2014) 21 : 483-491.
- Omori K, Shikata Y, Sarai K, Watanabe N, Wada J, Goda N, Kataoka N, Shikata K and Makino H: Edaravone mimics sphin- gosine-1-phosphate-induced endothelial barrier enhancement in human microvascular endothelial cells. Am J Physiol Cell Physiol (2007) 293 : C1523-C1531.
- Morozumi J, Mishima S, Ohta S, Fujikawa T, Sasaki H, Noda M and Yukioka T: The role of edaravone on the impairment of endothelial barrier function induced by acute oxidative stress in cultured human umbilical vein endothelial cell monolayer. J Trauma (2005) 59 : 570-574; discussion 574.
- Blecharz KG, Drenckhahn D and Forster CY: Glucocorticoids increase VE-cadherin expression and cause cytoskeletal rearrangements in murine brain endothelial cEND cells. J Cereb Blood Flow Metab (2008) 28 : 1139-1149.
- Jiang MZ, Tsukahara H, Ohshima Y, Sato S, Todoroki Y, Hiraoka M and Mayumi M: Effects of antioxidant and nitric oxide on chemokine production in TNF-alpha-stimulated human dermal microvascular endothelial cells. Free Radic Res (2004) 38 : 473480.
- Jiang MZ, Tsukahara H, Ohshima Y, Todoroki Y, Hiraoka M, Maeda M and Mayumi M: Effects of antioxidants and nitric oxide on TNF-alpha-induced adhesion molecule expression and NF-kappaB activation in human dermal microvascular endothelial cells. Life Sci (2004) 75 : 1159-1170.
- Tsuge M, Yasui K, Ichiyawa T, Saito Y, Nagaoka Y, Yashiro M, Yamashita N and Morishima T: Increase of tumor necrosis factoralpha in the blood induces early activation of matrix metalloprotei- nase-9 in the brain. Microbiol Immunol (2010) 54 : 417-424.
Кафедри педіатрії та вірології, Вища школа медицини університету Окаяма, Стоматологія та фармацевтичні науки, Окаяма 700-8558, Японія