ЮРіЯ-ФАРМ запустила соціальний проект “Впевнений шлях до одужання − Ксаврон проти інсульту”
ЖИТТЯ – це головна земна цінність і ключовою місією ЮРіЯ-ФАРМ є зберігати і покращувати його! ЮРіЯ-ФАРМ, як Корпорація з високим рівнем соціальної відповідальності, турбується про якість життя та стан здоров’я пацієнтів з гострим ішемічним інсультом та запустила соціальний проект “Впевнений шлях до одужання − Ксаврон проти інсульту”, який триватиме до вересня 2024 року включно. Мета соціального проекту: […]
Вплив Едаравону на атрофію м’язів та опорно-рухову функцію у пацієнтів з ішемічним інсультом (рандомізоване контрольоване пілотне дослідження)
Передумови та мета: Пацієнти з інсультом і тяжким паралічем ніг часто виявляються прикутими до ліжка в гострій та підгострій фазі захворювання, що збільшує ризик виникнення м’язової атрофії в хронічній фазі. Наявні на сьогодні дані вказують на те, що оксидативний стрес відіграє важливу роль у механізмі атрофії бездіяльних м’язів. Таким чином, метою цього дослідження було визначити, чи […]
Опубліковано: Drugs R D 2010; 10 (3)
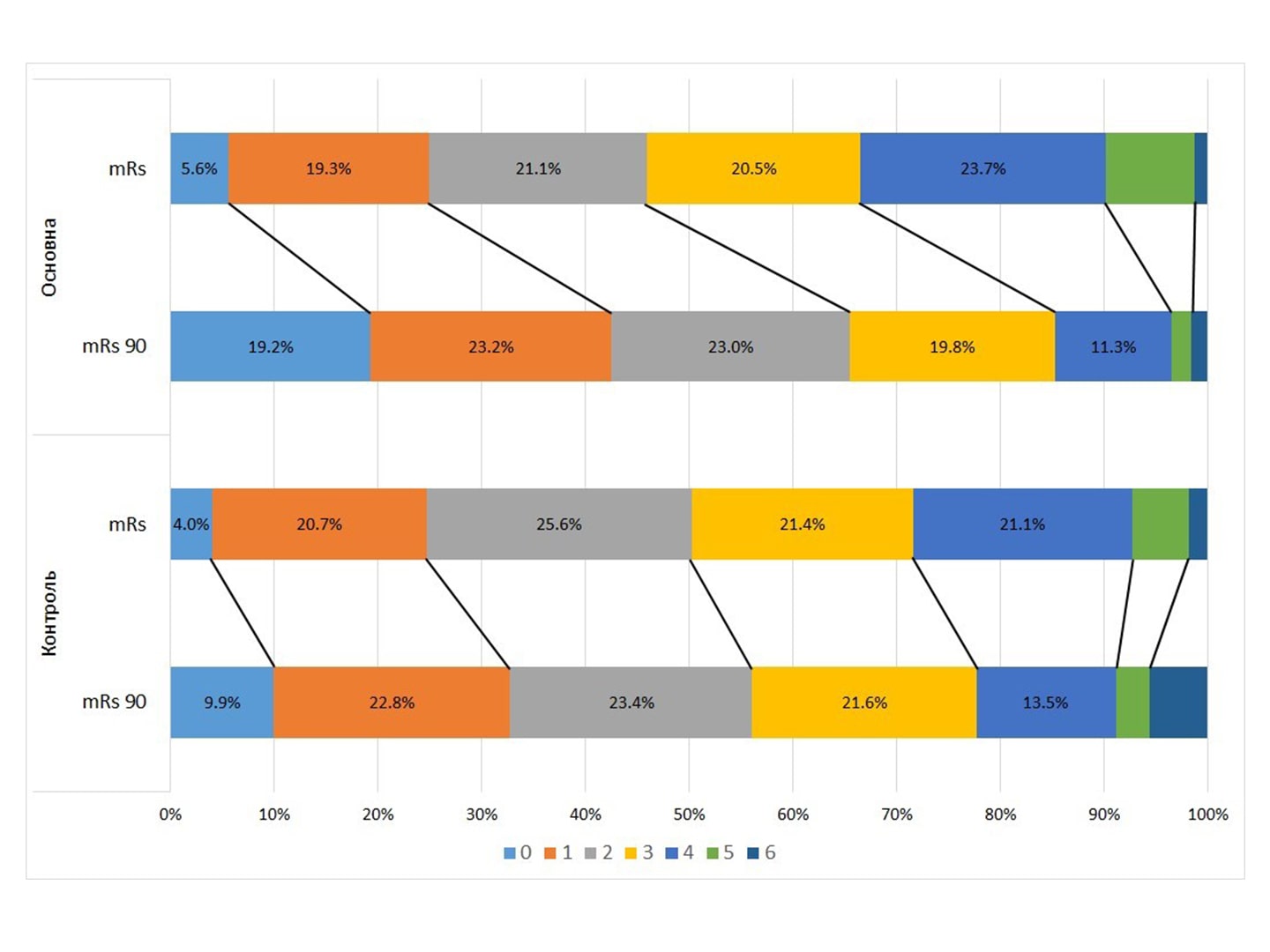
Остаточна оцінка результатів дослідження СТІКс (Супутня Терапія Інсульту Ксавроном)
Резюме. Ішемічний інсульт залишається актуальною проблемою сьогодення. Його патогенез складається з послідовного каскаду реакцій у мозку, які, на додаток до ішемії, відповідальні за подальше пошкодження мозкової тканини й уповільнюють розвиток компенсаторних і регенеративних механізмів. Спроби перервати патологічний каскад тривають декілька десятиліть. Першою перспективною молекулою, що продемонструвала в доклінічних дослідженнях потенціал скавенджера (прибиральника, поглинача) надлишкових агресивних перекисів, […]
Опубліковано: Міжнародний неврологічний журнал, том 17, № 5, 2021
Судинні неврологічні ускладнення у пацієнтів з COVID-19
У статті розглянуто сучасні погляди на розвиток та перебіг коронавірусної інфекції COVID-19. Особливу увагу приділено судинним неврологічним ускладненням. З метою оптимізації лікування цереброваскулярних ускладнень у пацієнтів із супутнім COVID-19 застосовували препарати едаравону та цитиколіну й електролітів. Проаналізовано клінічні та параклінічні дані 34 пацієнтів. Доведено, що зазначена комбінація лікарських засобів може бути рекомендована для широкого застосування […]
Опубліковано: УКР. МЕД. ЧАСОПИС, 2 (142) – III/IV 2021
Нові можливості фармакотерапії пацієнтів із гострим ішемічним інсультом
До вашої уваги представлено огляд статті M. Kaste et al. «Safety, Tolerability and Pharmacokinetics of MCI‑186 in Patients with Acute Ischemic Stroke: New Formulation and Dosing Regimen», опублікованої у виданні Cerebrovascular Diseases (2013; 36: 196–204), що присвячена аналізу результатів дослідження безпеки, переносимості та фармакокінетики нової схеми введення та режиму дозування едаравону в пацієнтів із гострим ішемічним інсультом. Дослідження […]
Опубліковано: НЕЙРОNEWS, 6 (117) '2020, ст. 46-49
Проміжні результати дослідження СТІКс (Супутня Терапія Інсульту Ксавроном) — відкритого багатоцентрового дослідження «випадок — контроль»
У статті наведено результати першого етапу дослідження СТІКс — відкритого багатоцентрового дослідження «випадок — контроль». Проміжний аналіз результатів (interim analysis) дає можливість переконатись у тенденціях на користь робочої гіпотези, дозволяє вчасно оцінити недоліки створеного протоколу та відповідає вимогам академічної та медичної доброчесності — відкритості в оприлюдненні результатів. Усього за період із березня до вересня 2020 […]
Опубліковано: THE JOURNAL OF NEUROSCIENCE of B.M. Mankovskyi’ 2021, VOLUME 9, № 1
Застосування препаратів едаравону, цитиколіну й електролітів та L-аргініну в пацієнтів із гострим порушенням мозкового кровообігу
У статті представлено результати застосування цитопротекторної терапії, застосованої на додаток до традиційного лікування пацієнтів із гострим порушенням мозкового кровообігу. Актуальним напрямом у лікуванні пацієнтів із ГПМК є застосування цитопротекторів, які можуть бути ефективним доповненням до тромболізису. Ці засоби захищають ішемізовані нейрони та нейросудинні одиниці від незворотних ушкоджень, посилюють нейропластичність і сприяють процесу відновлення нервової тканини. […]
Опубліковано: Нейроnews 9(120), 2020
ЯПОНСЬКІ РЕКОМЕНДАЦІЇ З МЕНЕДЖМЕНТУ ІНСУЛЬТУ 2015 РОКУ, ДОПОВНЕНІ У 2017 РОЦІ.
Рекомендації: Едаравон, препарат з очікуваним нейропротекторним ефектом, рекомендований як лікарський засіб для пацієнтів з ішемічним інсультом головного мозку (тромбоемболією) (ступінь В).
Опубліковано: Міжнародний неврологічний журнал, №1 (103), 2019
Догляд та лікування в гострому періоді інсульту: необхідне, достатнє та межі дозволеного
Актуальність роботи: публікація містить огляд основних положень для організації догляду за пацієнтами в гострому періоді інсульту, що ґрунтуються на поточних рекомендаціях і найкращому клінічному досвіді. Мета публікації: допомогти новим інсультним центрам в організації процесу ведення хворих, доповнивши документальний супровід (локальний протокол та маршрут пацієнта) ключовими положеннями з догляду для мінімізації ризиків ускладнень і збільшення шансів […]
Кохранівська база даних систематичних оглядів. Едаравон для лікування гострого ішемічного інсульту.
Дані експериментальних та клінічних досліджень показали, едаравон може бути корисним для пацієнтів з гострим ішемічним інсультом. Ціль огляду: оцінити ефективність та безпеку едаравону при гострому ішемічному інсульті. Основні результати. Автори включили три випробування. Доза ін’єкцій едаравону в трьох випробуваннях була однаковою і становила 60 мг на добу, а тривалість курсу лікування 14 днів. В групі едаравону спостерігалось […]
Опубліковано: Кохранівська база даних систематичних оглядів 2011.
Алгоритми дій, мінімальні умови та складові надання якісної медичної допомоги при гострому інсульті
Актуальність роботи: лікування гострого інсульту потребує застосування процедури документального менеджменту, лікувальні заклади мають різні ресурси та умови надання медичної допомоги, у параметри реформи закладені «індикатори якості надання послуг» за принципом їхнього регулярного загального оприлюднення, згідно рекомендацій 10-го круглого столу академічної науки STAIR залишається нагальною потреба у цитопротекції та захисті нейроваскулярного юніту. Ключова мета публікації – запропонувати основи […]
Протокол відкритого багатоцентрового дослідження «випадок – контроль» …
Протокол відкритого багатоцентрового дослідження «випадок – контроль» щодо безпеки та ефективності використання едаравону (Ксаврон®) у гострому періоді ішемічного інсульту в умовах реальної клінічної практики На вітчизняному фармакологічному ринку з’явився препарат класу скавенджерів (прибиральників) активних радикалів та перекисних сполук. Це препарат Ксаврон виробництва «Юрія-Фарм», діючою речовиною якого є едаравон. Едаравон був схвалений FDA для лікування БАС (боковий аміотрофічний […]
Опубліковано: Медична газета «Здоров’я України». Спецвипуск «Інсульт». Додаток № 1 (52), 2020 р.