Передумови та мета: Пацієнти з інсультом і тяжким паралічем ніг часто виявляються прикутими до ліжка в гострій та підгострій фазі захворювання, що збільшує ризик виникнення м’язової атрофії в хронічній фазі. Наявні на сьогодні дані вказують на те, що оксидативний стрес відіграє важливу роль у механізмі атрофії бездіяльних м’язів.
Таким чином, метою цього дослідження було визначити, чи є можливим запобігання розвитку атрофії бездіяльних м’язів після гострого інсульту й поліпшення опорно-рухової функції ніг у хронічній фазі під час тривалого лікування з акцептором вільних радикалів Едаравоном.
Методи: Це рандомізоване контрольоване пілотне дослідження було проведено в 19 центрах, що займаються дослідженням проблем гострого інсульту й реабілітацією після нього по всій Японії. Сорок сім пацієнтів з ішемічним інсультом із руховою слабкістю ніг, які буди доправлені протягом 24 годин після раннього початку захворювання, були випадковим чином розподілені для отримання неперервних внутрішньовенних інфузій Едаравону по 30 мг двічі на день протягом 3 днів (короткострокова група) або 10–14 днів (група тривалого лікування).
Первинні кінцеві точки дослідження включали ступінь м’язової атрофії внаслідок нерухомості ніг, виміряний за відсотковою зміною від початкового рівня обводу стегнового м’яза на 15 см вище коліна, та поліпшення опорно-рухової функції ніг, що оцінюється за максимальною швидкістю ходьби понад 10 м, через 3 місяці після початку інсульту.
Результати: Тримісячне спостереження було завершено над 41 пацієнтом (21 у короткостроковій групі та 20 у довгостроковій групі). Під час госпіталізації пацієнтів до стаціонару не було істотної різниці щодо тяжкості наслідків інсульту чи ступеня парезу ніг між двома групами, що проходили курс лікування. Ступінь атрофії бездіяльних м’язів і частота порушення ходи через 3 тижні після початку інсульту в групах короткострокового та довгострокового лікування також були однакові.
При цьому атрофія бездіяльних м’язів паретичних і непаретичних ніг була значно менш серйозною в разі довгострокового лікування порівняно з групою, що проходила короткострокове лікування (3,6 ± 5,9 % та 1,5 ± 6,0 % проти 8,3 ± 5,2 % та 5,7 ± 6,4 %; p <0,01 та p <0,05) через 3 місяці після початку інсульту. Крім того, максимальна швидкість ходьби на відстань 10 м була значно вищою в групі, що проходила тривале лікування (98 ± 67 проти 54 ± 55 см/сек; p <0,05).
Висновок: Лікування препаратом Едаравон протягом терміну до 14 днів пригнічує розвиток атрофії бездіяльних м’язів та поліпшує опорно-рухову функцію ніг більшою мірою, ніж у разі короткострокового лікування пацієнтів із гострим інсультом. Це свідчить про те, що можна поліпшити результати лікування інсульту за допомогою довгострокової терапії Едаравоном, забезпечуючи міопротекторні ефекти, які поліпшують функціональний наслідок захворювання у хронічній фазі.
Вступ
Інсульт — це проблема світового масштабу, основна причина смерті та інвалідності серед дорослого населення.[1] Одним із найпоширеніших симптомів інсульту є рухова слабкість, яка може призвести до значного порушення повсякденної діяльності, такої як харчування, купання, одягання та догляд за пацієнтом.
Під час церебрального інфаркту часто порушуються рухові шляхи лобної кори, променистого вінця, внутрішньої капсули або варолієвого моста, що призводить до розвитку геміпарезу нижніх кінцівок та подальшої дисфункції опорно-рухового апарату ніг під час хронічної фази інсульту. [2]
Проте локомоторна дисфункція ніг зумовлена не лише ішемічним церебральним ушкодженням трактів рухових нейронів, а й може бути почасти спричинена атрофією м’язів паралізованих та непаралізованих ніг. Ба більше, дослідження на маленькій вибірці серед здорових літніх людей продемонструвало, що 10 днів ліжкового режиму поспіль спричинювали істотні втрати в масі та функції скелетних м’язів, особливо в нижніх кінцівках[3].
Пацієнти з гострим інсультом з тяжким геміпарезом або паралічем можуть залишатися прикутими до ліжка протягом як мінімум 1–2 тижнів і часто не можуть ходити, незважаючи на проходження реабілітації протягом кількох тижнів. Пацієнти проводять цей тривалий період прикутими до ліжка під час гострої та підгострої фаз інсульту, що є ймовірною причиною атрофії м’язів нижніх кінцівок, пов’язаних із руховою слабкістю ніг, що прискорює розвиток рухової дисфункції ніг у хронічній фазі захворювання.[4,5]
Вперше на роль оксидативного стресу в процесі атрофії бездіяльних м’язів дослідники звернули увагу в 1990-ті роки.[6-8] Хоча точні механізми виникнення атрофії бездіяльних м’язів у пацієнтів залишаються нез’ясованими, наявні на сьогодні дані допомогли встановити важливу роль, яку відіграє оксидативний стрес у розвитку атрофії бездіяльних м’язів.[9,10]
Поглинач вільних радикалів Едаравон являє собою нейропротекторний препарат, показаний для лікування гострого інсульту в Японії з 2001 року. І, як було показано, залежно від дози поліпшує функціональні результати у пацієнтів з гострим ішемічним інсультом.[11-13] Едаравон може віддавати електрон ліпідному пероксильному радикалу, що спричинює перетворення на ліпідний пероксильний аніон.[14]
Едаравон уловлює вільні радикали, що утворюються під час активації каскаду арахідонової кислоти під час церебральної ішемії-реперфузії, та інгібує перекисне окислення ліпідів вільними радикалами.[14] Як показали дослідження, Едаравон захищає ендотелій судин та зменшує ушкодження нейрональних і гліальних клітин, поглинаючи вільні радикали.[14-17]
В Японії рекомендована тривалість приймання Едаравону становить 14 днів, але у пацієнтів із легкими симптомами її можна скоротити.[18] Ранні клінічні дослідження показали, що нейрональні клітини не можуть вижити більше ніж кілька годин після ішемії та що явища, які спричинюють загибель клітин, тривають протягом декількох днів.
Ці дослідження показали, що нейропротекторні препарати можуть чинити захисну дію, якщо розпочати їх приймання протягом кількох годин після ішемії та продовжувати протягом кількох днів.[19,20] На підставі цих даних, для забезпечення адекватної церебропротекції вважається достатнім приймати препарат Едаравон упродовж 3 днів. Унно та співавт.[12] повідомили, що тривалість терапії препаратом Едаравон вплинула на функціональний результат у пацієнтів з гострим ішемічним інсультом.
Крім того, дослідження, проведені на лабораторних тваринах, показують, що процес м’язової атрофії, спричиненої тривалою м’язовою неактивністю, починається вже через кілька днів після іммобілізації ноги.[6-10] Це свідчить про те, що терапію акцептором радикалів слід призначати протягом тривалішого періоду, якщо вона застосовується для пригнічення розвитку м’язової атрофії, пов’язаної з бездіяльністю м’язів, спричиненою впливом радикалів.
Метою цього пілотного дослідження під назвою MARVELOUS (Стримування м’язової атрофії за допомогою неперервного Едаравону, який застосовувався під час довгострокового лікування після інсульту) було визначити, чи може тривале лікування препаратом Едаравон, що містить поглинач вільних радикалів, (i) пригнітити розвиток атрофії бездіяльних м’язів після гострого інсульту; та (ii) зменшити ступінь порушення ходи під час хронічної фази захворювання.
Пацієнти й методи
Пацієнти
До цього клінічного дослідження були залучені пацієнти з непослідовним гострим інсультом, доправлені до відділення для лікування гострого інсульту протягом 24 годин після раннього початку захворювання. Пацієнти допускалися до клінічних досліджень за такими критеріями, як вік 20–79 років, наявність під час госпіталізації до відділення моторної слабкості ніг 2–4 за шкалою інсульту Національного інституту здоров’я (NIHSS) та відсутність явної функціональної інвалідності до інсульту, що оцінювалося за допомогою модифікованої Оціночної шкали Ренкіна (mRS) від 0 до 1.
Критерії вилучення з цього клінічного дослідження: гіперчутливість до Едаравону та його компонентів в анамнезі, супутні нервово-м’язові захворювання, обструктивні захворювання стегнової артерії, застійна серцева недостатність, значні ниркові/печінкові захворювання, геморагічний інсульт, застосування тромболітичної терапії, 20 чи більше балів за Японською шкалою коми, неврологічний анамнез, дисфункція з показником mRS > 2, штучні колінні або тазостегнові суглоби, креатинін сироватки > 1,5 мг/дл, злоякісні захворювання, вагітність або участь в іншому клінічному дослідженні.
Це клінічне дослідження було схвалено місцевим Комітетом з етики кожного інституту, що бере участь у дослідженні, та проводилося відповідно до Гельсінської декларації Всесвітньої медичної асоціації та Етичних рекомендацій для епідеміологічних досліджень Міністерства освіти, культури, спорту, науки і технологій Японії, а також Міністерства охорони здоров’я, праці та соціального забезпечення Японії. Усі пацієнти дали письмову інформовану згоду до включення до клінічного дослідження і були централізовано зареєстровані через Інтернет.
Схема проведення дослідження
Дослідження являло собою відкрите рандомізоване контрольоване пілотне дослідження, яке проводилося у 19 інститутах, зокрема 13 центрах з дослідження гострого інсульту і шести реабілітаційних центрах у Японії. Для реєстрації та розподілу пацієнтів, які беруть участь у клінічному дослідженні, використовувався централізований метод розподілу/реєстрації через Інтернет; для перевірки кандидатів використовувалися попередньо зареєстровані індивідуальні дані та пароль.
Записи про пацієнтів у журналі дослідження включали час госпіталізації, назву лікарні, вік, стать, ступінь тяжкості захворювання (моторний показник геміпаретичної нижньої кінцівки за шкалою NIHSS), ім’я та прізвище реєстратора, який увів дані.
Рандомізація дослідження проводилася за контрольними факторами, такими як назва лікарні, вік, стать і моторна підшкала активності геміпаретичної нижньої кінцівки NIHSS, і пацієнти були розподілені на дві контрольні групи у співвідношенні 1:1. Контрольні групи пацієнтів були рандомізовані для отримання Едаравону (30 мг двічі на день) внутрішньовенно протягом 3 днів (група короткострокової терапії) або 10–14 днів (група довгострокової терапії).
Усі пацієнти були госпіталізовані до центру лікування гострих інсультів і пройшли стаціонарну терапію з подальшою реабілітацією амбулаторно. Час початку реабілітаційної терапії було розподілено на чотири категорії: (i) у день госпіталізації; (ii) протягом 3 днів від госпіталізації; (iii) протягом 7 днів від госпіталізації; та (iv) через 8 або більше днів після госпіталізації. Після завершення гострофазової реабілітаційної терапії пацієнти були переведені до центру постінсультної реабілітації.
Слід зазначити, що лікарі центру лікування гострого інсульту відповідали за подальші оцінки об’єму м’язів ніг та рухової функції пацієнтів через 3 тижні та/або 3 місяці після настання інсульту у пацієнтів, які були переведені до реабілітаційного центру, не пов’язаного з дослідницькою групою MARVELOUS. Пацієнти, переведені до реабілітаційного центру MARVELOUS, були обстежені лікарем реабілітаційного центру.
Процедури
Під час госпіталізації пацієнтів їм було введено препарат Едаравон (Radicut® корпорації Митцубіші Танабе Фарма, Осака, Японія). Пацієнти отримували 30 мг препарату Едаравон двічі на день, який розчиняли в 100 мл фізіологічного розчину та вводили неперервною внутрішньовенною інфузією протягом 30 хвилин. Едаравон вводили протягом 3 днів поспіль у групі короткострокового лікування та протягом 10–14 днів у групі тривалого лікування.
Оцінка кінцевих точок дослідження
Первинні кінцеві точки дослідження включали зміни порівняно з початковим рівнем у ступені атрофії м’язів через бездіяльність ніг і тяжкість рухової дисфункції ніг через 3 місяці після початку інсульту.
Атрофія м’язів через бездіяльність ніг визначалася як зменшення (виражене у відсотках) від початкового рівня (протягом 4 днів після госпіталізації) об’єму стегнового м’яза через 3 тижні та 3 місяці після раннього початку інсульту, яке оцінювалося шляхом вимірювання обводу стегнового м’яза обох ніг на 5, 10 і 15 см вище коліна, коли пацієнти перебували в положенні лежачи на спині з випростаними ногами.
Тяжкість рухової дисфункції оцінювалася на підставі стадії відновлення Бруннстрема (BRS)[21] та максимальної швидкості ходи (MWS) на відстань 10 м.
Статистичний аналіз
Згідно з неопублікованими даними попереднього дослідження пацієнтів з ішемічним інсультом, які отримують лікування препаратом Едаравон, «хороша» рухова функція (mRS 0–2) через 3 місяці після початку інсульту спостерігалася у 17 % і 60 % пацієнтів, які отримували препарат Едаравон протягом 3 і 14 днів відповідно.
На підставі цих висновків розрахунки розміру вибірки з використанням потужності 80 % показали, що для виявлення різниці у первинній кінцевій точці лікування потрібно мінімум 38 пацієнтів, у яких передбачався двосторонній рівень значущості 0,05.
Ці дослідження були виражені у відсотках для категоріальних змінних або у вигляді середніх значень для неперервних змінних. Для статистичного порівняння категоріальних змінних використовувався критерій хі-квадрат Пірсона (χ2) або точний критерій Фішера. Для порівняння відмінностей у ступені атрофії бездіяльних м’язів та MWS між двома групами також використовувався непарний параметричний t-критерій Стьюдента.
Крім того, було проведено простий регресійний аналіз для оцінки кореляції між ступенем атрофії м’язів паралізованої ноги та максимальною швидкістю ходьби. Значення p < 0,05 вважалося статистично значущим для цього дослідження. Статистичний аналіз проводився з використанням ПЗ Microsoft ® Office Excel 2003.
Результати
Протягом одного року з 1 січня 2007 р. до 31 грудня 2007 р. для участі в дослідженні було зареєстровано загалом 47 відповідних пацієнтів. Тримісячне спостереження успішно завершено за 41 із 47 пацієнтів; дані цих пацієнтів були включені до аналізу цього клінічного дослідження.
Шість пацієнтів, які не завершили тримісячне спостереження, були вилучені з аналізу з таких причин: розвиток крововиливу в мозок протягом періоду подальшого спостереження після початку приймання препарату (n = 1); відміна приймання препарату Едаравон через виникнення порушень функцій печінки під час лікування (n = 1); неможливість продовжувати інфузію препарату більше ніж 1 день через серцеву недостатність у пацієнта (n = 1); протягом періоду подальшого спостереження реабілітація не проводилася через супутню пневмонію та інші ускладнення у пацієнта (n = 1); і припинення спостереження з особистих причин (n = 2).
Таким чином, аналіз було проведено у 21 пацієнта в групі короткострокового лікування (3 дні лікування Едаравоном) та у 20 пацієнтів у групі тривалого лікування (10–14 днів лікування).
Таблиця I показує детальне резюме характеристик пацієнтів із двох досліджуваних груп. Під час цього клінічного дослідження не було зафіксовано значних відмінностей у підтипах інсульту, тяжкості інсульту, визначеній за шкалою NIHSS, або ступеню парезу ноги на ураженій стороні, визначеного за моторною підшкалою NIHSS через такі фактори, як вік, стать та інші фактори ризику.
Усі пацієнти короткострокової групи отримували лікування препаратом Едаравон протягом 3 днів; середнє значення ± стандартне відхилення тривалості лікування препаратом Едаравон у групі довгострокового лікування становило 13,6 ± 1,2 дні.
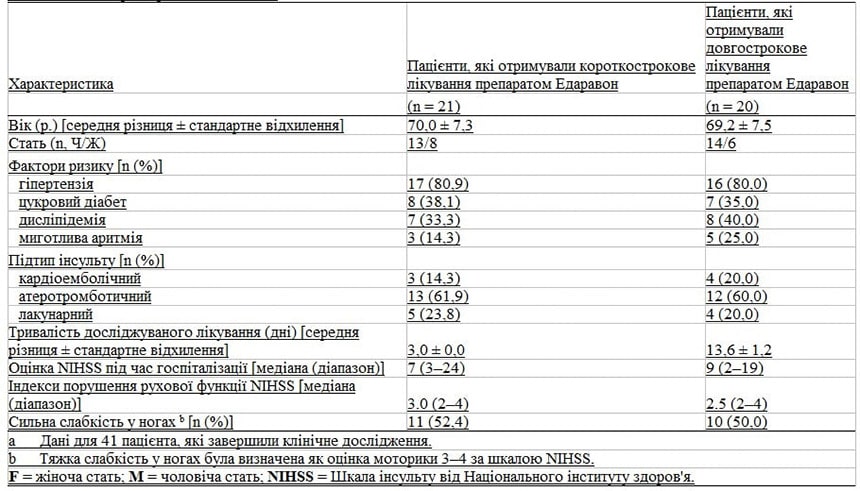
У таблиці II зроблено порівняння стану пацієнтів після реабілітації в гострій фазі, частоти порушення ходи через 3 тижні після початку інсульту і тяжкості атрофії м’язів через бездіяльність ніг через 3 тижні після початку інсульту в групах короткострокового та тривалого лікування препаратом Едаравон. Час початку стаціонарної та амбулаторної реабілітаційної терапії, а також загальний термін реабілітації були однакові у двох контрольних групах пацієнтів.
Порушення ходи через 3 тижні після раннього початку інсульту визначалося як прикутість до інвалідного крісла або прикутість до ліжка та реєструвалася у 47,6 % і 45,0 % пацієнтів у групах короткострокового та довгострокового лікування відповідно.
Тяжкість м’язової атрофії паретичних і непаретичних ніг внаслідок бездіяльності (виміряна на 15 см вище коліна) була чисельно вищою в групі короткострокового лікування (5,0 ± 3,4 % та 3,7 ± 4,4 % відповідно) порівняно з групою, що отримувала тривале лікування (4,4 ± 4,1 % та 2,0 ± 3,8 % відповідно) через 3 тижні після початку інсульту, але ця різниця не була статистично значущою.
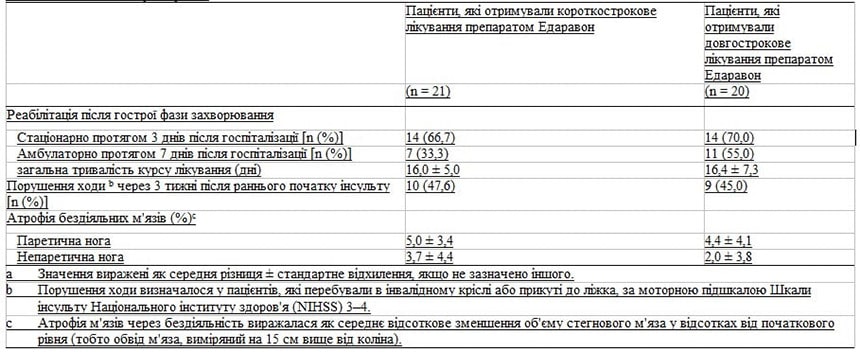
Вплив лікування препаратом Едаравон на ступінь атрофії м’язів через невикористання кінцівок та рівень рухомої функції ніг під час хронічної фази (через 3 місяці після початку інсульту) наведено в Таблиці III.
Ступінь атрофії бездіяльних м’язів (тобто відсоткове зниження об’єму стегнового м’яза порівняно з початковим рівнем) у паретичних та непаретичних ногах на висоті 15 см вище коліна був значно менш серйозним у групі тривалого лікування порівняно з групою короткострокового лікування (3,6 ± 5,9 % та 1,5 ± 6,0 % проти 8,3 ± 5,2 % та 5,7 ± 6,4 %; p < 0,01 та p < 0,05).
Таблиця I. Характеристики пацієнтіва
Таблиця II. Реабілітація на гострій фазі захворювання, порушення ходи і тяжкість атрофії бездіяльних м’язів через 3 тижні після початку інсультуа
Аналогічна тенденція до атрофії м’язів у разі їхньої бездіяльності також спостерігалася під час оцінки на 5 і 10 см вище від коліна (дані не показано).
Значне поліпшення опорно-рухової функції ніг було пов’язано з тривалим лікуванням препаратом Едаравон, за даними обстеження пацієнтів та оцінки у них максимальної швидкості ходьби було проведено простий регресійний аналіз (97,9 ± 67,3 проти 53,6 ± 54,8 см/сек; p < 0,05 порівняно з групою короткострокового лікування).
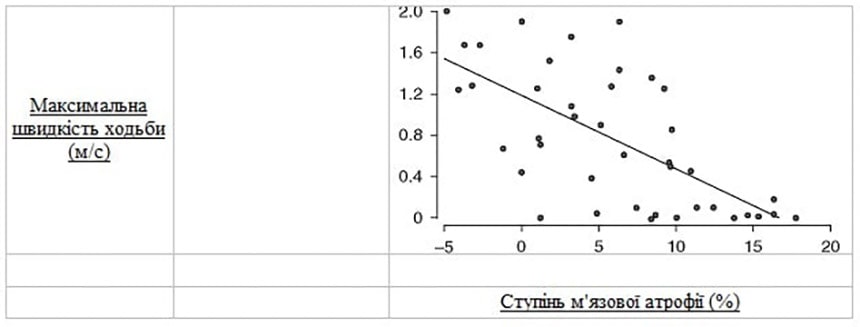
У більшої частини пацієнтів у групі тривалого лікування також спостерігалася краща опорно-рухова функція ніг, аніж у групі короткострокового лікування (70,0 % проти 57,1 %), як це визначено у пацієнтів на стадії відновлення Бруннстрема на рівні 5–6, але ця різниця не була статистично значущою. Врешті було виявлено значну від’ємну кореляцію між тяжкістю атрофії бездіяльних м’язів у паретичній нозі та максимальною швидкістю ходьби (r = -0,87; p < 0,001) [Рисунок 1].
Обговорення
Препарат Едаравон, який діє як акцептор радикалів, на сьогодні є єдиним церебропротекторним засобом, схваленим для клінічного використання під час лікування гострого інсульту. Було показано, що він поліпшує функціональний результат лікування захворювання на гострий ішемічний інсульт у японських пацієнтів [11-13].
У ХХ столітті не менше ніж 30 речовин, шо мають церебропротекторну дію, пройшли III фазу клінічних досліджень на пацієнтах із гострим інсультом; ці дослідження дали негативні результати щодо поліпшення клінічної ефективності, за винятком препарату Едаравон.[22-24] Проте клінічні дані щодо препарату Едаравон слід інтерпретувати обережно через низку істотних відмінностей у структурі дослідження, проведеного щодо препарату Едаравон, порівняно з іншими церебропротекторними засобами.
Таблиця III. Вираженість атрофії бездіяльних м’язів та рівень опорно-рухової функції ніг через 3 місяці після початку інсультуа
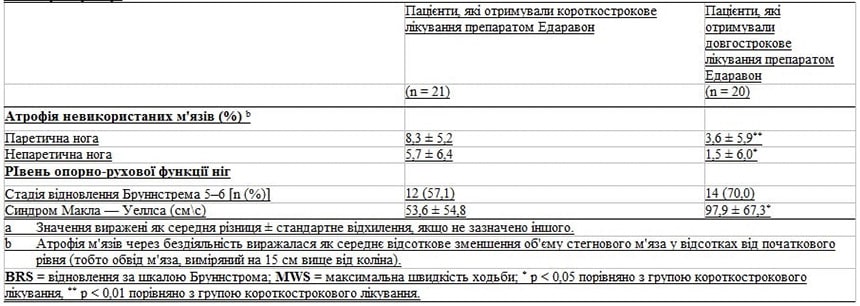
Рис. 1. Взаємозв’язок між ступенем м’язової атрофії паретичної ноги та максимальною швидкістю ходьби (МШХ). МШХ зменшується кореляційно зі збільшенням ступеня атрофії паралізованої ноги (r = -0,87; p < 0,001). Таким чином, атрофія чинить значний негативний вплив на здатність пацієнтів до ходьби.
По-перше, Едаравон можна було вводити протягом 72 годин з моменту раннього початку інсульту, але в дослідженнях із застосуванням інших церебропротекторних засобів цей період було обмежено в межах 6–12 годин з моменту початку. По-друге, під час дослідження пацієнтів, які приймали Едаравон, обсяг інфаркту, як правило, був меншим, що спричинювало незначні неврологічні симптоми, такі як рухова слабкість; різні вищі кортикальні дисфункції спостерігалися в інших дослідженнях, участь у яких брали пацієнти з більш крупними інфарктами.
Врешті, Едаравон можна вводити протягом періоду до 14 днів порівняно з коротким періодом 1–3 дні в інших дослідженнях, таких як SAINT (лікування гострого ішемічного інсульту NXY-059 [під час лікування антиоксидантом Cerovive]) на II стадії клінічних досліджень [25].
Результати III фази клінічного дослідження препарату Едаравон дозволяють припустити, що позитивні ефекти препарату можуть бути почасти пов’язані з міопротекторними ефектами.[11] На підставі цієї гіпотези було проведено це пілотне дослідження, аби визначити міопротекторні ефекти Едаравону у пацієнтів із гострим інсультом.
У цьому дослідженні пацієнти були випадковим чином розподілені на групи щодо терапії препарату Едаравон протягом 3 або 14 днів; вважалося, що в цій останній фазі така тривалість приймання препарату є достатньою для забезпечення церебропротекторної та міопротекторної дії.
Атрофія м’язів через бездіяльність — це явище, яке спостерігається в клінічній практиці, коли пацієнти тривалий час є прикутими до ліжка, або під час тривалого відпочинку з обмеженою активністю та/або рухомістю. Атрофія скелетних м’язів виникає внаслідок скорочення або атрофії м’язових волокон. [9,10]
Хоча точний механізм початку процесу атрофії бездіяльних м’язів залишається незрозумілим, у цьому дослідженні повідомляються експериментальні результати, які показали тісний взаємозв’язок між оксидативним стресом та атрофією бездіяльних м’язів [6-8] Ба більше, дослідження атрофічних м’язів лабораторних щурів показало підвищений вміст речовин, що реагують на відсутність тіобарбітурової кислоти, та окисленого глутатіону, які є маркерами оксидативного стресу.
Крім того, на збільшення утворення супероксид-радикальних аніонів (O2−) вказувало підвищення активності Cu/Zn-вмісної супероксиддисмутази в цитоплазмі атрофованих м’язових клітин, а в разі атрофії м’язів через 12 днів бездіяльності рівень ксантиноксидази збільшувався в 2,2 разу щодо контрольного рівня. Справді, гістохімічні дослідження з використанням просвічувальної електронної мікроскопії виявили підвищенні рівні активних форм кисню (перекисів), таких як H2O2, в атрофічних м’язах. [6-8]
Також було показано, що активні метали, такі як залізо, збільшують оксидативний стрес в атрофічних м’язах, і під час введення заліза через хелатувальний агент дефероксамін пригнічувалося зростання кількості реактивних речовин тіобарбітурової кислоти й окисленого глутатіону в атрофічних м’язах щурів. [26]Останніми роками роль заліза в оксидативному стресі привернула пильну увагу в галузі фізіології.[9,10]
Ще одним фактором, що може впливати на процес розвитку м’язової атрофії, є підвищення рівнів внутрішньоклітинних іонів кальцію (Ca2+) під час м’язової неактивності. [6-8] РІвні Ca2+ в цитоплазмі атрофованих м’язових клітин були приблизно в 4 рази вищі, ніж рівні в нормальних м’язових клітинах.
Таке накопичення внутрішньоклітинного Ca2+ під час бездіяльності м’язів може відбуватися через іонні збурення в молекулах клітинної мембрани, які сповільнюють виведення Ca2+клітинами. Це результуюче підвищення цитозольного Ca2+ може призвести до активації кальцій-залежних протеаз, що призводить до руйнування м’язової тканини.
Було показано, що, крім індукції м’язової атрофії під час бездіяльності м’язів, оксидативний стрес посилюється під час процесу відновлення від атрофії у лабораторних щурів.[27] Це свідчить про те, що вивільнення вільних радикалів, як і раніше, відбуватиметься у тих пацієнтів, які проходять відновлення після атрофії бездіяльних м’язів.
У цьому дослідженні неперервне введення препарату Едаравон, акцептора вільних радикалів, протягом тривалого періоду, що становив 14 днів, було корисним для пацієнтів, які проходять м’язову терапію при невикористанні, чимало з яких почали реабілітацію амбулаторно після кількох днів ліжкового режиму. Таким чином, двотижневий період лікування препаратом Едаравон виявляється ефективним як у період бездіяльності м’язів, так і в період відновлення м’язової активності.
У цьому дослідженні не виявлено значних відмінностей щодо тяжкості атрофії м’язів між двома контрольними групами лікування через 3 тижні після початку інсульту, але було виявлено значне поліпшення на користь групи з довгостроковим лікуванням з періодом 3 місяці.
Це може бути пояснено відкладеним залученням до процесу апоптозу протягом періоду атрофії бездіяльних м’язів, що у остаточному підсумку призводить до скорочення та/або загибелі м’язових клітин.[9,10] Унаслідок вищеописаних процесів клінічні прояви м’язової атрофії можуть не проявитися доти, доки відбуваються зміни у м’язовому внутрішньоклітинному середовищі протягом кількох тижнів.
Обмеження цього дослідження включають невеликий розмір вибірки та відсутність плацебо або контрольної групи (тобто стандартної терапії без застосування препарату Едаравон). Ще одним обмеженням застосування препарату була неможливість незалежно оцінити церебропротекторний та міопротекторний ефекти впливу препарату Едаравон.
Експериментальне дослідження на щурах з використанням моделі оклюзії середньої мозкової артерії показало, що окислювальне ушкодження клітин у головному мозку щура вочевидь проявляється протягом як мінімум 7 днів.[28] Крім того, час повторного кровотоку в людей із церебральним інфарктом варіювався залежно від закупореності кровоносної судини та підтипу інсульту.[29]
Це дослідження показало, що тривалість порушення, спричиненого стресом, значно варіюється, і є імовірність, що спостережені переваги при атрофії бездіяльних м’язів у групі пацієнтів із тривалим лікуванням можуть бути частково пов’язані з сильнішим церебропротекторним ефектом препарату Едаравон.
Якщо це справді так, то слід переглянути поширену думку про те, що процес загибелі нейрональних клітин під час ішемічної хвороби майже завершується протягом 2–3 днів після раннього початку інсульту, і слід провести подальші клінічні дослідження з вивчення ефективності застосування церебропротекторних засобів протягом триваліших періодів лікування.
Висновок
Результати нашого дослідження показали, що лікування акцептором вільних радикалів Едаравон протягом 14 днів ефективно знижує ступінь атрофії бездіяльних м’язів та рухову дисфункцію ніг у хронічній фазі захворювання.
На підставі цих висновків, використання антиоксидантної терапії протягом якомога тривалішого терміну видається виправданим для забезпечення максимального рівня як церебропротекції, так і міопротекції. Для підтвердження позитивного впливу препарату Едаравон під час лікування інсульту необхідні більші рандомізовані контрольовані клінічні випробування.
Подяка
Це клінічне дослідження фінансувалося грантом (H-18-Chojyu-Ippan-040) від Міністерства охорони здоров’я, праці та соціального забезпечення Японії. Автори цієї роботи не мають конфлікту інтересів, який безпосередньо стосується змісту цього дослідження. Допомогу в написанні медичних документів надав Максвелл Чанг (Maxwell Chang) із Департаменту наукових комунікацій компанії Волтерз Клювер. Ця допомога була профінансована компанією Міцубіші Танабе Фарма (Mitsubishi Tanabe Pharma Corporation).
Членами дослідницької групи MARVELOUS Study Group є такі організації: Лікарня Сенрі Чуо (Х. Наритомі, Н. Ое) / Senri Chuo Hospital (H. Naritomi, H. Oe); Національний церебральний та серцево-судинний центр (Х. Моривакі, К. Сайто) / National Cerebral and Cardiovascular Center (H. Moriwaki, K. Saito); Центр лікування інсульту Хіросакі (Н. Метокі) / Hirosaki Stroke Center (N. Metoki); Нейрохірургічна лікарня Нішиноміия Кіоритцу (Х. Нішимура) / Nishinomiya Kyoritsu Neurosurgical Hospital (H. Nishimura); Центральна лікарня Хімедзі (Й. Хігаші) / Himeji Central Hospital (Y. Higashi); Друга лікарня Червоного Хреста Кіото (Ю. Ямамото) / Second Red Cross Hospital (Y. Yamamoto); Лікарня загального профілю Тосей (Х. Юаса) / Tosei General Hospital (H. Yuasa); Університет Тояма (K. Tanaka) / Toyama University (K. Tanaka); Медичний університет Івате (Ю. Тараяма) / Iwate Medical University (Y. Tarayama); Міжнародний медичний центр Медичного університету Сайтама (Н. Танахаши) / Saitama Medical University International Medical Center (N. Tanahashi); Центральна лікарня Токіо Сайсекай (М. Такагі) / Tokyo Saiseikai Central Hospital (M. Takagi); Науково-дослідний інститут мозку та кровоносних судин Акіта (К. Нагата) / Research Institute for Brain and Blood Vessels Akita (K. Nagata); Шпиталь Сайто Юкокаї (T. Ода) / Saito Yukoukai Hospital (T. Oda); Префектурний реабілітаційно-психіатричний центр Акіта (Є. Йокояма) / Akita Prefectural Rehabilitation and Psychiatric Center (E. Yokoyama); Реабілітаційна лікарня Тояма Коші (Й. Іноуе) / Toyama Koshi Rehabilitation Hospital (Y. Inoue); Медичний коледж Хіого (K. Домен) / Hyogo College of Medicine (K. Domen); Медична школа Сайтама (M. Маджима) / Saitama Medical School (M. Majima); Центр реабілітації Івате (A. Такагаші) / Iwate Rehabilitation Center (A. Takahashi); Університет Кіюшу (Х. Кондо) / Kyushu University (H. Kondo).
Список літератури
- Donnan GA, Fisher M, Macleod M, et al. Stroke. Lancet 2008 May 10; 371 (9624): 1612-23
- Schneider R, Gautier JC. Leg weakness due to stroke: site of lesions, weakness patterns and causes. Brain 1994 Apr; 117 (Pt 2): 347-54
- Kortebein P, Ferrando A, Lombeida J, et al. Effect of 10 days of bed rest on skeletal muscle in healthy older adults. JAMA 2007 Apr 25; 297 (16): 1772-4
- Kondo K, Ota T. Changes with time in cross-sectional areas of leg muscles in early stroke rehabilitation patients: disuse muscle atrophy and its recovery. Jpn J Rehabil Med 1997; 34: 124-33
- Odajima N, Ishiai S, Okiyama R, et al. CT findings of leg muscles in the hemiplegics due to cerebrovascular accidents: correlation to disuse atrophy. Rinsho Shinkeigaku 1987 Sep; 27 (9): 1154-62
- Kondo H. Oxidative stress in skeletal muscle atrophy induced by immobilization. In: Reznick AZ, editor. Oxidative stress in skeletal muscle. Basel: Birkhauser, 1998: 197-13
- Kondo H. Oxidative stress in muscular atrophy. In: Sen CK, Hanninen O, editors. Handbook of oxidants and antioxidants in exercise. Amsterdam: Elsevier, 2000: 631-53
- Kondo H, Itokawa Y. Oxidative stress in muscular atrophy. In: Sen CK, Packer L, Hanninen O, editors. Exercise and oxygen toxicity. Amsterdam: Elsevier, 1994: 319-42
- Powers SK, Kavazis AN, DeRuisseau KC. Mechanisms of disuse muscle atrophy: role of oxidative stress. Am J Physiol Regul Integr Comp Physiol 2005 Feb; 288 (2): R337-44
- Powers SK, Kavazis AN, McClung JM. Oxidative stress and disuse muscle atrophy. J Appl Physiol 2007 Jun; 102 (6): 2389-97
- Edaravone Acute Infarction Study Group. Effect of a novel free radical scavenger, edaravone (MCI-186), on acute brain infarction: randomized, placebo-controlled, double-blind study at multicenters. Cerebrovasc Dis 2003; 15 (3): 222-9
- Unno Y, Katayama M, Shimizu H. Does functional outcome in acute ischaemic stroke patients correlate with the amount of free-radical scavenger treatment? A retrospective study of edaravone therapy. Clin Drug Investig 2010; 30 (3): 143-55
- Lapchak PA. A critical assessment of edaravone acute ischemic stroke efficacy trials: is edaravone an effective neuroprotective therapy? Expert Opin Pharmacother 2010; 11 (10): 1753-63
- Yamamoto Y, Kuwahara T, Watanabe K. Antioxidant activity of 3-methyl-1-phenyl-2-pyrazolin-5-one. Redox Rep 1996; 2: 333-8
- Lee BJ, Egi Y, van Leyen K, et al. Edaravone, a free radical scavenger, protects components of the neurovascular unit against oxidative stress in vitro. Brain Res 2010 Jan 11; 1307: 22-7
- Ueno Y, Zhang N, Miyamoto N, et al. Edaravone attenuates white matter lesions through endothelial protection in a rat chronic hypoperfusion model. Neuroscience 2009 Aug 18; 162 (2): 317-27
- Yamamoto T, Yuki S, Watanabe T, et al. Delayed neuronal death prevented by inhibition of increased hydroxyl radical formation in a transient cerebral ischemia. Brain Res 1997 Jul 11; 762 (1-2): 240-2
- Мицубиси Танабе Фарма Корпорейшн Radicut (edaravone) [Japanese prescribing information]. Osaka: Mitsubishi Tanabe Pharma Corporation, 2009
- Astrup J, Siesjo BK, Symon L. Thresholds in cerebral ischemia: the ischemic penumbra. Stroke 1981 Nov-Dec; 12 (6): 723-5
- Heiss WD. Experimental evidence of ischemic thresholds and functional recovery. Stroke 1992 Nov; 23 (11): 1668-72
- Brunnstrom S. Motor testing procedures in hemiplegia: based on sequential recovery stages. Phys Ther 1966 Apr; 46 (4): 357-75
- Dorman PJ, Counsell CE, Sanderrock PAG. Recently developed neuroprotective therapies for acute stroke: a qualitative systematic review of clinical trials. CNS Drugs 1996; 5 (6): 457-74
- Ginsberg MD. Neuroprotection for ischemic stroke: past, present and future. Neuropharmacology 2008 Sep; 55 (3): 363-89
- O’Collins VE, Macleod MR, Donnan GA, et al. 1,026 experimental treatments in acute stroke. Ann Neurol 2006 Mar; 59 (3): 467-77
- Shuaib A, Lees KR, Lyden P, et al. NXY-059 for the treatment of acute ischemic stroke. N Engl J Med 2007 Aug 9; 357 (6): 562-71
- Kondo H, Miura M, Kodama J, et al. Role of iron in oxidative stress in skeletal muscle atrophied by immobilization. Pflugers Arch 1992 Jun; 421 (2-3): 295-7
- Kondo H, Kodama J, Kishibe T, et al. Oxidative stress during recovery from muscle atrophy. FEBS Lett 1993 Jul 12; 326 (1-3): 189-91
- Yamamoto Y, Yanagisawa M, Tak NW, et al. Repeated edaravone treatment reduces oxidative cell damage in rat brain induced by middle cerebral artery occlusion. Redox Rep 2009; 14 (6): 251-8
- Houkin K, Ueno K, Tada M, et al. Arterial recanalization in an acute stage of cerebral infarction. Neurol Med Chir (Tokyo) 1987 Apr; 27 (4): 295-301
Опубліковано: Drugs R D 2010; 10 (3)