ЮРіЯ-ФАРМ запустила соціальний проект “Впевнений шлях до одужання − Ксаврон проти інсульту”
ЖИТТЯ – це головна земна цінність і ключовою місією ЮРіЯ-ФАРМ є зберігати і покращувати його! ЮРіЯ-ФАРМ, як Корпорація з високим рівнем соціальної відповідальності, турбується про якість життя та стан здоров’я пацієнтів з гострим ішемічним інсультом та запустила соціальний проект “Впевнений шлях до одужання − Ксаврон проти інсульту”, який триватиме до вересня 2024 року включно. Мета соціального проекту: […]
Нові можливості застосування блокатора ішемічного каскаду в терапії гострого інфаркту міокарда
Резюме. Окисний стрес відіграє особливу роль при гострому коронарному синдромі (ГКС), зокрема, є провідною ланкою патогенезу реперфузійного пошкодження міокарда. Продукти вільнорадикального окиснення можуть запускати процеси загибелі кардіоміоцитів та бути відповідальними за 50 % кінцевого розміру зони некрозу при ГКС, виникнення реперфузійних аритмій, систолічної мікросудинної дисфункції. Тому адекватна антиоксидантна терапія, спрямована на елімінацію активних форм кисню, активацію […]
Опубліковано: Медицина невідкладних станів, Том 18, № 1, 2022
Вплив Едаравону на атрофію м’язів та опорно-рухову функцію у пацієнтів з ішемічним інсультом (рандомізоване контрольоване пілотне дослідження)
Передумови та мета: Пацієнти з інсультом і тяжким паралічем ніг часто виявляються прикутими до ліжка в гострій та підгострій фазі захворювання, що збільшує ризик виникнення м’язової атрофії в хронічній фазі. Наявні на сьогодні дані вказують на те, що оксидативний стрес відіграє важливу роль у механізмі атрофії бездіяльних м’язів. Таким чином, метою цього дослідження було визначити, чи […]
Опубліковано: Drugs R D 2010; 10 (3)
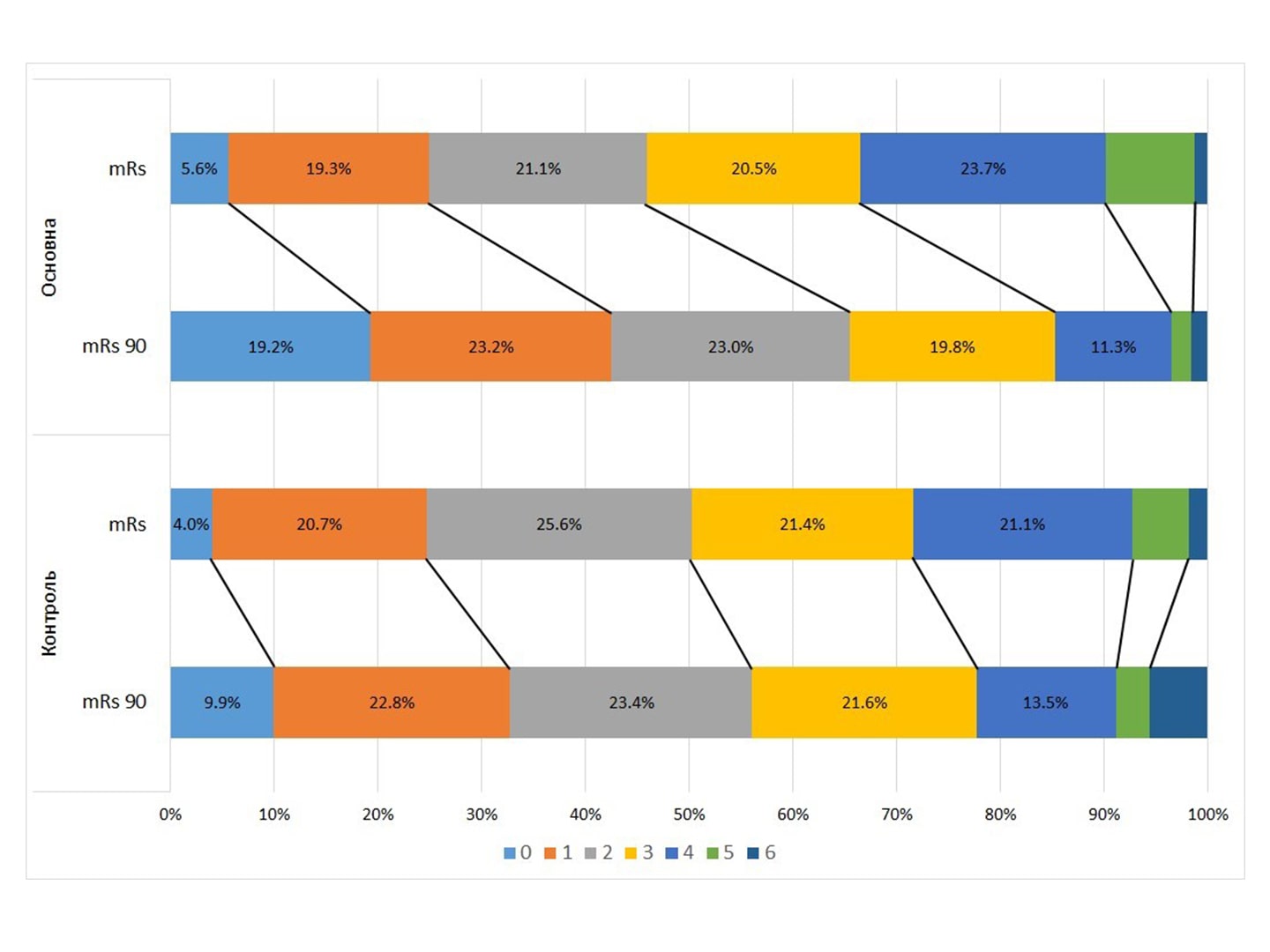
Остаточна оцінка результатів дослідження СТІКс (Супутня Терапія Інсульту Ксавроном)
Резюме. Ішемічний інсульт залишається актуальною проблемою сьогодення. Його патогенез складається з послідовного каскаду реакцій у мозку, які, на додаток до ішемії, відповідальні за подальше пошкодження мозкової тканини й уповільнюють розвиток компенсаторних і регенеративних механізмів. Спроби перервати патологічний каскад тривають декілька десятиліть. Першою перспективною молекулою, що продемонструвала в доклінічних дослідженнях потенціал скавенджера (прибиральника, поглинача) надлишкових агресивних перекисів, […]
Опубліковано: Міжнародний неврологічний журнал, том 17, № 5, 2021
Неврологічні порушення в пацієнтів, які перенесли COVID-19: як лікувати в умовах пандемії
Резюме. У статті подано огляд даних світової літератури стосовно уражень нервової системи в пацієнтів, які перенесли COVID-19. Також наведені результати власного відкритого порівняльного дослідження ефективності комплексного застосування Ксаврону, Тіворелю й Ксилату в пацієнтів з неврологічними порушеннями в постковідному періоді. Був продемонстрований позитивний вплив вищезазначеного комплексу препаратів на когнітивні функції, що виражалось в збільшенні темпу психічної […]
Опубліковано: Міжнародний неврологічний журнал, Том 17, N 6, 2021
Як швидко повернутися до звичного життя після перенесеного COVID-19. Актуальне інтерв’ю.
? В студії Олег Чабан, доктор медичних наук, завідувач кафедри психології, психосоматичної медицини та психотерапії Національного медичного університету імені Богомольця та Олександр Галушко, доктор медичних наук, професор кафедри анестезіології та інтенсивної терапії НУОЗУ імені Шупика. Після перенесеного COVID-19 пацієнти зіткнулись з постковідним синдромом. Стан, коли навіть після отриманого негативного тесту на коронавірус, відчувається постійна втома, […]
Постковідний синдром: патогенез та основні напрями реабілітації
Спалах коронавірусної інфекції (COVID‑19), що з’явилася в Китаї у грудні 2019р. і швидко переросла в пандемію світового масштабу, продовжує залишатися однією з найсерйозніших проблем людства. Наразі накопичилося чимало даних, які пояснюють природу зумовленого коронавірусом SARS‑CoV‑2 тяжкого гострого респіраторного дистрес‑синдрому (ГРДС) з погляду вірусології, епідеміології та клінічної тактики. Сьогодні науковці всього світу наполегливо працюють над створенням […]
Опубліковано: Здоров’я України № 2 (495), 2021
Методи корекції неврологічних порушень у пацієнтів із коронавірусною хворобою (COVID-19)
Мета роботи. Проаналізувати частоту виникнення та спектр неврологічних порушень у пацієнтів із коронавірусною хворобою, запропонувати методи вдосконалення патогенетичного лікування. Матеріали та методи. Обстежено 83 пацієнта з коронавірусною хворобою, госпіталізованих до КНП ХОР«Обласна клінічна інфекційна лікарня» протягом періоду з травня до грудня 2020 р. Пацієнти були поділені на групи залежно від ступеня тяжкості хвороби та залежно від призначеної […]
Опубліковано: Клінічна інфектологія та паразитологія, 2021, том 10, № 2
Судинні неврологічні ускладнення у пацієнтів з COVID-19
У статті розглянуто сучасні погляди на розвиток та перебіг коронавірусної інфекції COVID-19. Особливу увагу приділено судинним неврологічним ускладненням. З метою оптимізації лікування цереброваскулярних ускладнень у пацієнтів із супутнім COVID-19 застосовували препарати едаравону та цитиколіну й електролітів. Проаналізовано клінічні та параклінічні дані 34 пацієнтів. Доведено, що зазначена комбінація лікарських засобів може бути рекомендована для широкого застосування […]
Опубліковано: УКР. МЕД. ЧАСОПИС, 2 (142) – III/IV 2021
Нові можливості фармакотерапії пацієнтів із гострим ішемічним інсультом
До вашої уваги представлено огляд статті M. Kaste et al. «Safety, Tolerability and Pharmacokinetics of MCI‑186 in Patients with Acute Ischemic Stroke: New Formulation and Dosing Regimen», опублікованої у виданні Cerebrovascular Diseases (2013; 36: 196–204), що присвячена аналізу результатів дослідження безпеки, переносимості та фармакокінетики нової схеми введення та режиму дозування едаравону в пацієнтів із гострим ішемічним інсультом. Дослідження […]
Опубліковано: НЕЙРОNEWS, 6 (117) '2020, ст. 46-49
Ефективність тривалої терапії антиоксидантом із властивостями скевенджера у пацієнтів із бічним аміоторофічним склерозом
До вашої уваги представлено огляд статті J. Shefner et al. «Long-term edaravone efficacy in amyotrophic lateral sclerosis: Post-hoc analyses of Study 19 (MCI186–19)», опублікованої у виданні Muscle Nerve (2020; 61: 218–242), яка містить аналіз даних про ефективність тривалої терапії антиоксидантом едаравоном для зменшення прогресування цього тяжкого захворювання. Для кращого розуміння довгострокової ефективності терапії едаравоном у […]
Опубліковано: НЕЙРОNEWS 1, 2021
ЗДАТНІСТЬ ЕДАРАВОНУ знижувати підвищений рівень легкого ланцюга нейрофіламенту в пацієнтів із бічним аміотрофічним склерозом
У дослідженні оцінювали динаміку рівнів легкого ланцюга нейрофіламенту в сироватці крові та функціонального стану пацієнта за шкалою ALSFRS-R у пацієнтів із бічним аміотрофічним склерозом на тлі приймання препарату Ксаврон. Вміст легкого ланцюга нейрофіламенту сироватки крові корелює зі ступенем хронічного або гострого пошкодження мотонейронів при БАС і є біомаркером активності процесу та прогресування захворювання. Імовірна здатність […]
Опубліковано: НЕЙРОNEWS, 10 (121)' 2020, ст.38-44