Методи корекції неврологічних порушень у пацієнтів із коронавірусною хворобою (COVID-19)
Мета роботи. Проаналізувати частоту виникнення та спектр неврологічних порушень у пацієнтів із коронавірусною хворобою, запропонувати методи вдосконалення патогенетичного лікування. Матеріали та методи. Обстежено 83 пацієнта з коронавірусною хворобою, госпіталізованих до КНП ХОР«Обласна клінічна інфекційна лікарня» протягом періоду з травня до грудня 2020 р. Пацієнти були поділені на групи залежно від ступеня тяжкості хвороби та залежно від призначеної […]
Опубліковано: Клінічна інфектологія та паразитологія, 2021, том 10, № 2
Ефективність комбінованої терапії препаратами Ксаврон, Тіворель і Реосорбілакт у пацієнтів з пневмонією, спричиненою COVID-19: клінічні випадки
У публікації подано серію клінічних випадків пацієнтів із пневмоніями, спричиненими COVID-19, до схеми лікування яких було включено препарати Ксаврон, Тіворель і Реосорбілакт, що дозволило швидко досягти покращання стану пацієнтів і сприяло полегшенню перебігу захворювання. В умовах, коли етіотропні препарати, які діють безпосередньо на збудник COVID-19, ще не розроблені, надзвичайно важливим є комплексний синдромно-патогенетичний підхід до […]
Опубліковано: Новини медицини та фармації, № 1,2, 2021.
Нейроінвазія при коронавірусній інфекції: патогенез та перспективи лікування
Вірус SARS-CoV-2 має тропізм до клітин ЦНС і може викликати розвиток неврологічної симптоматики в інфікованих пацієнтів. У цьому контексті введення до схеми інтенсивної терапії едаравону (препарату Ксаврон®) може бути доцільним з огляду на його здатність зменшувати прояви не тільки оксидативного стресу, але й явищ «цитокінового шторму», а саме значущого зменшення вмісту ІЛ-6. Таким чином, у […]
Опубліковано: Спецвипуск «Інсульт», 2021 р. Здоров'я України
На передовій боротьби з COVID-19 – досвід українських спеціалістів (ВІДЕО)
Лікарі всього світу досі шукають та не можуть знайти ефективні засоби боротьби з COVID-19. Тому кожний практичний досвід є важливим. Дізнаймося чим українські лікарі рятують життя населення. Останнім досвідом з передової вітчизняні спеціалісти ділились в рамках доповідей Міжнародного Конгресу з Інфузійної Терапії. Пропонуємо Вашій увазі короткий огляд секції, що викликала найбільшу увагу серед глядачів. На […]
Опубліковано: IV Міжнародний конгрес з інфузійної терапії (12-13 жовтня 2020 року)
Едаравон: акцептор вільних радикалів із численними плейотропними ефектами може виявитися революційним продуктом щодо попередження та полегшення цитокінового шторму, спричиненого COVID-19
В процесі такого нормального фізіологічного процесу, як клітинне дихання, утворюється невелика кількість окислювальних активних форм кисню (АФК) та активних форм азоту (АФА). Ці вільні радикали відіграють ключову роль в активації сигнальних шляхів у клітинах тварин та рослин. Це хімічно високоактивні молекули, які можуть ушкоджувати клітинні структури. Проте існують системи захисту (акцепторні) або актиоксидантні системи, які […]
Опубліковано: Journal of Medical Science and Clinical Research Vol 08, Issue 07, Page 227-236, July
Нейроінвазія та неврологічні ускладнення при COVID-19 (ВІДЕО)
У відео на основі наявних публікацій систематизовані відомості про механізми нейроінвазії, основні форми ураження периферичної та центральної нервової систем та їх клінічні прояви при СOVID-19. Обговорюються методи діагностики та лікувальна тактика при різних нозологічних формах. Представлено пілотне дослідження вивчення впливу едаравону на маніфестацію IL-6 у пацієнтів з COVID-19.
Опубліковано: IV Міжнародний конгрес з інфузійної терапії (12-13 жовтня 2020 року)
Потенційні можливості лікування COVID-19: протидія надмірному запаленню, антиоксидантний вплив і цитопротекція
Зважаючи на небезпеку пандемії, що й досі не стихає, існує потреба в розробленні нових схем лікування коронавірусної хвороби (COVID‑19), у тому числі в переосмисленні вже знайомих, добре вивчених препаратів і застосуванні їх у новому контексті. Причиною мультиорганного пошкодження та смерті при тяжких випадках COVID‑19 є надмірне та некероване вивільнення певних прозапальних цитокінів і хемокінів (Huang […]
Опубліковано: Медична газета «Здоров'я України», 2020
Едаравон: потенційне лікування запального синдрому, спричиненого COVID-19?
У публікації надано механізм дії: системне введення едаравону виробляє захисні ефекти проти запалення та травм на моделях тварин, спричинених хімічним ураженням легенів, нирок, кишечника, підшлункової залози, мозку та печінки. Едаравон також знижує рівні певних цитокінів (IL-2, IL-6, IL-1β, TNF-α) та хемокінів (IL-8, MCP-1, MIP-1a, 2,5); активні форми кисню та оксиду азоту. Запропоновано дизайн дослідження, клінічним […]
Опубліковано: Pharmacological Research 160 (2020) 105055
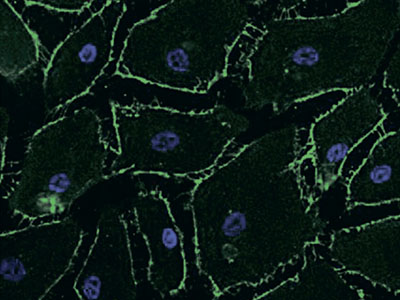
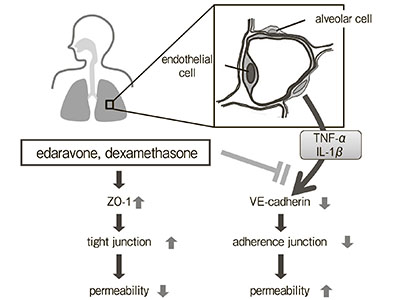
Інгібуючий ефект едаравону, акцептора вільних радикалів, на підвищену проникність ендотеліоцитів мікроциркуляторного русла легень, спричинену цитокінами: порівняння з дексаметазоном та інгібітором синтази оксиду азоту
Підвищена легенева проникність відіграє роль у розвитку гострого респіраторного дистрес-синдрому (ГРДС), проте на сьогоднішній день немає доведених терапевтичних стратегій з контролю проникності мікроциркуляторного русла. Ми дослідили ефекти едаравону, дексаметазону та N-монометил-L-аргініну (L-NMMA) на зміни проникності ендотеліоцитів мікроциркуляторного русла легень людини (PMVEC – pulmonary microvascular endothelial cells) при гіперцитокінемії. Людські PMVEC були засіяні в камеру Бойдена. […]
Досвід застосування методів синдромно-патогенетичної терапії при пневмонії, спричиненій COVID-19, в умовах пульмонологічного відділення
На сьогодні надзвичайно актуальним є питання лікування пневмонії, спричиненої вірусом SARS-CoV-2. Коронавірусна хвороба (COVID-19) – нова інфекція, проти якої немає специфічних ліків і вакцин. Багато в чому несподіваними виявилися її ускладнення. Провідні спеціалісти сподіваються, що найближчим часом будуть розроблені вакцини та/або спеціальні терапевтичні препарати для лікування інфекції SARS-CoV-2. Поки цей пошук триває, лікарі в усьому […]
Опубліковано: Медична газета «Здоров'я України», № 13-14 (482-483), Липень 2020